Fecha: septiembre 2022
Félix Lobo*, Juan Oliva**, José Vida***
Asistencia sanitaria, Tecnologías sanitarias, Medicamentos, Financiación, Evaluación económica, Eficiencia, Coste-efectividad
Resumen breve
El propósito de este documento es ofrecer un análisis crítico de la evolución y situación actual de la evaluación de la eficiencia de las tecnologías sanitarias en España. Para ello se lleva a cabo un recorrido por la incorporación del criterio de eficiencia en la decisión de financiación y establecimiento del precio de los nuevos avances en la asistencia sanitaria, tanto por lo que respecta a los medicamentos como para el resto de tecnologías sanitarias. De esta manera se puede identificar cuál es el fundamento de la inclusión de la dimensión de la eficiencia en los procesos de evaluación y toma de decisiones, y cuáles han sido las barreras que han obstaculizado la configuración de un verdadero sistema de evaluación de la eficiencia de las tecnologías sanitarias en nuestro país, al tiempo que se lleva a cabo un recorrido por la actividad desempeñada en este campo y se ofrece una visión panorámica del estado actual de la cuestión.
Resumen
El propósito de este documento es ofrecer un análisis crítico de la evolución y situación actual de la evaluación económica o de la eficiencia de las tecnologías sanitarias (EETS) en España. Después de resumir la naturaleza de la EETS, se expone las barreras que han impedido su desarrollo sistemático en España que sí se ha producido en otros países avanzados. La sección tres describe y valora la evolución de su régimen jurídico, dispar para medicamentos y otras tecnologías sanitarias y que calificamos de fragmentado, asistemático, discontinuo, parcial e insuficiente. La sección cuatro repasa cómo ha evolucionado la práctica de la EETS en España y la cinco recoge los últimos avances y la situación actual. Termina con unas conclusiones y reflexiones finales. A las dificultades organizativas de la EETS en nuestro país los mismos autores dedicamos otro documento de próxima publicación por Funcas.
La EETS –muchas veces llamada “análisis coste efectividad”– compara los beneficios terapéuticos y sociales y los costes sanitarios y sociales de tratamientos y programas alternativos. Se añade, pues, a los criterios clásicos de seguridad, eficacia y calidad. Forma parte de la familia del análisis coste-beneficio y es un eslabón clave en la cadena de la evaluación de las tecnologías sanitarias. La EETS es relevante dada la limitación de nuestros recursos que tienen un coste de oportunidad. Es necesaria porque las TS operan en marcos extraordinariamente complejos; pueden estar en la frontera más avanzada del conocimiento; continuamente se producen innovaciones; es muy difícil disponer de la información necesaria para valorarlas de manera individual e informal y, además, esta información no solamente es imperfecta, sino también asimétrica. La EETS también es útil a todos los niveles como ayuda a la toma de decisiones sobre adopción de nuevas TS –uno de los grandes motores del gasto sanitario–garantizando la asignación eficiente de los recursos, la solvencia de los sistemas sanitarios y podría defenderse que también contribuye a la equidad. Las decisiones deben apoyarse en criterios técnicos claros y objetivos, y en una sólida metodología científico-técnica, pero los argumentos técnicos no pueden sustituir a las decisiones políticas y profesionales. En suma, la EETS es una herramienta fundamental para conseguir que los recursos se empleen en las intervenciones que generan mejores resultados en salud. No puede extrañar que sea un área científica y profesional muy activa y en plena expansión internacional. Puede ser también una expresión del buen gobierno del sistema sanitario, que muchos consideran que todavía es deficitario en nuestro país.
Hacia 1990, Australia y Canadá comenzaron a aplicar criterios de eficiencia como fundamento de las decisiones de precio y financiación pública de medicamentos. En 1999, se sumaría el británico National Institute for Health and Care Excellence (NICE), referente internacional en este ámbito. Posteriormente se unirían otros países como Suecia, Países Bajos, Portugal o Francia, en Europa, o Corea del Sur y Japón, en el Lejano Oriente.
Por el contrario, la EETS no está implantada de manera sólida y sistemática en España. ¿Por qué? ¿Cómo es que no ha despegado la EETS en España a pesar de contar con investigadores reconocidos en el campo, haber abordado propuestas de estandarización metodológicas y contar con varias agencias especializadas ya a fines del Siglo XX?
Los propios decisores del sector han identificado barreras administrativas, metodológicas y de aplicación práctica que han condicionado el desarrollo de la EETS en nuestro país. Por nuestra parte insistiríamos en la importancia de las barreras políticas (como el carácter polémico de las decisiones sobre asignación de recursos escasos y el rechazo de las instancias políticas a perder su control); la ausencia de modelos aplicables procedentes de otros sectores, así como factores históricos y culturales. Ante estas barreras ha faltado determinación política para implantar un verdadero sistema de incorporación de los avances tecnológicos en nuestro sistema sanitario que tuviera en cuenta el criterio de la eficiencia. Debemos señalar, sin embargo, que España no ha sido el único país en afrontar barreras a la inclusión de dicho criterio.
En cuanto a la evolución del régimen jurídico de la EETS, detallada en la sección tres, se recuerda que el marco constitucional y legal general exige el cumplimiento del principio de eficiencia en la asignación de los recursos. Las normas específicas del sector con rango de ley más importantes –aunque insuficientes– han sido la Ley 25/1990 del Medicamento, la Ley de Cohesión y Garantías del Sistema Nacional de Salud, de 2003 y el Real Decreto Ley 9/2011. Regulan separadamente, por un lado, la EETS de los medicamentos y, por otro, las demás tecnologías sanitarias. Sin embargo, la falta de concreción y de desarrollo reglamentario y metodológico ha sido un límite infranqueable a su desarrollo –por lo menos en el caso de los medicamentos– que además deja un amplio margen de discrecionalidad que genera mucha incertidumbre a pacientes, profesionales sanitarios y empresas. Tampoco parece óptimo que las Administraciones Públicas lleven a cabo de forma separada la evaluación de los medicamentos y del resto de tecnologías sanitarias.
La regulación de la evaluación de las tecnologías sanitarias, exceptuados los medicamentos, es relativamente satisfactoria. El Real Decreto Ley 16/2012 creó la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud (RedETS) en función de la organización territorial del Estado en comunidades autónomas. Por el contrario, la regulación de la EETS de los medicamentos es calificable de fragmentada, asistemática, discontinua, parcial e insuficiente, situación que requiere una iniciativa ambiciosa para mejorarla y completarla a todos los niveles normativos. Esta indefinición ha hecho que, en la práctica, las decisiones en materia de eficiencia se sigan adoptando al nivel de la meso e incluso de la microgestión.
En España, la práctica de la EETS –analizada en la sección cuatro– no es marginal y la tendencia del número de trabajos realizados es creciente, aunque su cantidad, sin embargo, ha sido modesta. En particular, el desarrollo de estudios concretos de evaluación económica de los medicamentos para apoyar las decisiones específicas de la Administración sobre su posicionamiento terapéutico y de financiación pública y precios a lo largo del tiempo ha sido muy limitado. La calidad de los estudios concretos aún presenta margen de mejora, con debates similares a los que se reproducen a nivel internacional sobre aspectos controvertidos. Los actores públicos más activos son la RedETS, el Comité Mixto de Evaluación de Nuevos Medicamentos formado por seis CC. AA., la Comissió d’Avaluació Econòmica i d’Impacte Pressupostari (CAEIP) del Servei Català de la Salut (CatSalut), hasta su desaparición en 2019 y el Servicio Canario de la Salud. En el ámbito privado, sociedades profesionales y científicas (GENESIS, SEFH, AES), la industria farmacéutica y de productos sanitarios, y consultoras especializadas, además de los investigadores que desarrollan su labor en la universidad, han mantenido una actividad creciente.
La sección cinco recoge los últimos avances y la situación actual. Se aprecia una voluntad política positiva para hacer avanzar la EETS. Se ha concretado ya en iniciativas concretas de planificación (Plan para los Informes de Posicionamiento Terapéutico (IPT), organización (REvalMED…), sistemas de información (Valtermed), dotación presupuestaria y formación. El trascendental Reglamento (UE) 2021/2282 del Parlamento Europeo y del Consejo de 15 de diciembre de 2021 sobre evaluación de las tecnologías sanitarias, establece un marco común que se constituirá como punto de referencia imprescindible.
Las conclusiones del informe son claras (sección seis). La EETS no ha terminado de implantarse sólida y sistemáticamente en España, especialmente en el caso de los medicamentos. El marco legal y la práctica de las Administraciones sanitarias deberían haberla normalizado hace tiempo como herramienta de ayuda para la toma de decisiones. El desarrollo pleno de normas, estructuras organizativas y procedimientos que fundamenten las decisiones incorporando la dimensión de eficiencia, bajo las premisas de la calidad técnico-científica, transparencia en los procesos, rendición de cuentas y participación es una de las asignaturas pendientes de nuestro Sistema Nacional de Salud para garantizar de forma plena el derecho a la protección de la salud.
Reformas recientes en la evaluación de la eficiencia de los medicamentos apuntan a un cambio esperanzador. Sin embargo, el camino por recorrer es largo y exige acciones de amplio alcance, incluso desarrollos legislativos al máximo nivel. Se requiere determinación política para terminar de superar las barreras que se oponen a ello, así como incentivos, coordinación y liderazgo adecuados.
La EETS es una exigencia ineludible en la actualidad para cualquier sistema sanitario desarrollado. No evaluar incorporando toda la información disponible supone un coste social de oportunidad difícilmente justificable. La alternativa a introducir elementos claros y objetivos en el diseño y evaluación de las políticas sanitarias es actuar desde la opacidad, sin responsabilidad ni rendición de cuentas a la ciudadanía y supone dejar campo libre a grupos de presión y elementos mediáticos al fijar el orden del día de las políticas de salud. Otros países han incorporado hace tiempo estas herramientas en sus procesos de toma de decisiones y también tenemos en España ejemplos de buenas prácticas.
La evaluación, no ya la económica, sino la evaluación, en sentido amplio, no es meramente una opción o un conjunto de herramientas relativamente útil. Es parte del gran cambio que precisamos para garantizar una cultura de buen gobierno y la solvencia de nuestro sistema de salud y para que éste continúe mejorando el bienestar de nuestra sociedad, tal y como lo ha hecho en las últimas décadas.
1. UNA APROXIMACIÓN A LA EVALUACIÓN DE LA EFICIENCIA DE LAS TECNOLOGÍAS SANITARIAS
Las tecnologías sanitarias, entendidas en un sentido amplio, son “cualquier intervención desarrollada con el objetivo de prevenir, diagnosticar o tratar enfermedades o afecciones médicas, promover la salud, rehabilitar u organizar la prestación de servicios sanitarios. Estas intervenciones pueden ser pruebas diagnósticas, dispositivos médicos, fármacos, vacunas, procedimientos clínicos, programas o sistemas de provisión de servicios médicos” (O’Rourke, Oortwijl y Schuller, 2020). Desde un punto de vista jurídico, las tecnologías sanitarias se definen como “un medicamento, producto sanitario, o procedimientos médicos o quirúrgicos, así como las medidas para la prevención, el diagnóstico o el tratamiento de enfermedades utilizados en la asistencia sanitaria”1.
El Ministerio de Sanidad (2022) estima que en el año 2021 se destinaron 20.939 millones de euros a la financiación de medicamentos en el Sistema Nacional de Salud (SNS). Asimismo, según la Federación Española de Empresas de Tecnología Sanitaria (2022), en el mismo año, la facturación del mercado de tecnologías sanitarias (no medicamentosas) alcanzó la cifra de 9.500 millones de euros. Ambas cifras conjuntas suponen el 2,53 % del PIB del año 2021. En Europa las tecnologías sanitarias constituyen un sector innovador y generador de valor añadido a la economía, formando parte de un mercado global de asistencia sanitaria que representa el 10 % del producto interior bruto de la Unión2. Adicionalmente, el valor de las tecnologías sanitarias está más allá de su peso sobre el PIB ya que son pieza fundamental en las mejoras en esperanza y en calidad de vida experimentadas por la población española en las últimas décadas. Al tiempo, son uno de los principales factores impulsores del crecimiento del gasto sanitario público en la mayoría de países de nuestro entorno (Appleby, 2013).
La evaluación económica o de la eficiencia de tecnologías sanitarias (EETS) es una actividad cuya finalidad es examinar el valor de los recursos adicionales empleados en ellas y las ganancias en términos de salud que proporcionan, a corto y largo plazo, frente a sus mejores alternativas, en los individuos directamente afectados y en la sociedad. Muchas veces se designa como “análisis coste efectividad”, una traducción directa –y pobre– del inglés. La EETS forma parte de la familia del análisis coste-beneficio, aunque con especificidades notables, las cuales tienen que ver con el resultado evaluado (ganancia en salud). También está directamente emparentada con la evaluación general de las tecnologías sanitarias (ETS) que es un proceso científico basado en datos contrastados que permite determinar la eficacia relativa de tecnologías sanitarias existentes o nuevas, centrándose específicamente en el valor añadido de una tecnología sanitaria en comparación con otras tecnologías existentes o nuevas3. Así pues, la EETS es un eslabón más, pero importante, dentro de la familia de la ETS que consiste en un proceso multidisciplinar que resume información sobre los aspectos médicos, sociales y relativos a los pacientes, y las cuestiones económicas y éticas relacionadas con el uso de una tecnología sanitaria de manera sistemática, transparente, imparcial y rigurosa4. Es importante destacar que la ETS es una evolución del sistema de autorización y control de los medicamentos que surgió a partir de la catástrofe de la talidomida en los años sesenta del pasado siglo y que constituye un requisito legal imprescindible de la autorización para su comercialización. La ETS va más allá, pues no se limita al control de la eficacia, seguridad y calidad de los medicamentos o tecnologías sanitarias, sino que se fija en su seguridad y en su eficacia clínica relativas a través de una evaluación comparativa con las alternativas disponibles.
La justificación de la EETS parte del hecho de que no siempre es posible introducir una nueva tecnología ahorrando costes y mejorando resultados en salud. Lo habitual es que la introducción de innovaciones terapéuticas lleve aparejada un mayor coste. La cuestión, si se da tal situación, es si la ganancia en salud y bienestar inherente a la inclusión y uso de dicha innovación supera el coste de oportunidad de los recursos adicionales empleados. En terminología anglosajona diríamos que hay que asegurar un good value for money. En castellano no tenemos una expresión tan gráfica. “Buen retorno de la inversión” sería la expresión más aproximada. En todo caso, la cuestión relevante a señalar es que hay que buscar un buen equilibrio entre los costes asumidos y los resultados en salud alcanzados. Señalar qué es un buen equilibrio nos remite a la idea del valor social de las ganancias en salud y a la productividad del sector sanitario. Explicar con detalle estas ideas nos llevaría por otros caminos técnicos que no son objeto de este documento, pero podemos remitir al lector interesado a algunas lecturas al respecto5. En todo caso, vale la pena señalar que la investigación en el campo de las EETS puede ayudarnos en este empeño.
El punto de partida a considerar, por tanto, es que, además de los criterios clásicos de seguridad, eficacia y calidad de los programas y tecnologías utilizadas en el sistema sanitario, se debería contar con la dimensión de la eficiencia introduciendo la consideración de los costes, tanto en la toma de decisiones relacionadas con su uso más adecuado en la práctica habitual, como en las decisiones colectivas sobre el establecimiento del precio de una innovación y sobre su financiación pública, nada infrecuentes en este sector. El cuadro 1 describe estos criterios o garantías exigibles a una tecnología sanitaria para la entrada en el sistema sanitario.

La evaluación de la eficiencia es relevante desde el momento en el cual se cobra conciencia de la limitación de nuestros recursos: al decidir financiar una intervención, los recursos que exige no pueden ser empleados en otras alternativas (sanitarias o de otros ámbitos del bienestar como son las pensiones, la educación o la atención a la dependencia, entre otras). Por ello, cuando nos movemos en el terreno de las decisiones colectivas que implican el uso de recursos públicos, la exigencia es mayor que cuando aludimos a decisiones puramente privadas: no es suficiente tomar buenas decisiones, sino que se debe aspirar a que las decisiones sean las mejores posibles.
Junto a lo señalado, la EETS es necesaria porque la asistencia sanitaria y la salud pública operan en marcos extraordinariamente complejos. Las tecnologías pueden estar en la frontera más avanzada del conocimiento y continuamente se producen innovaciones. Resulta muy difícil disponer de la información necesaria para valorarlas de manera individual e informal. Por ello, se requiere aplicar métodos sistemáticos y con fundamento científico para informar las decisiones. Además, esta información no solamente es imperfecta, especialmente en el momento de entrada de la innovación al sistema sanitario, sino además asimétrica. Algunos agentes están mejor informados (por ejemplo, las empresas que las desarrollan y comercializan), mientras que otros (médicos, sistemas públicos de salud o aseguradoras sanitarias privadas que tienen que decidir incorporarlas y aplicarlas) pueden tener una información limitada. A ello se añade que estas decisiones de incorporación de tecnologías nuevas son cruciales para el bienestar de los ciudadanos por las mejoras en salud que pueden generar.
Por tanto, los resultados de las evaluaciones pueden ser útiles para que los profesionales sanitarios, las personas que tienen que tomar decisiones relativas a los servicios sanitarios, pacientes y ciudadanos conozcan cuál es la eficiencia (relación entre costes y efectos) de las distintas intervenciones sanitarias. Esta información, unida a otras, facilita la identificación e implementación de las opciones más favorables, permite la asignación más racional y transparente de unos recursos sanitarios limitados y contribuye a la mejora de la salud y el bienestar general.
En un momento de fuerte impulso innovador, la llegada de novedades terapéuticas (medicamentos, dispositivos, innovaciones organizativas…) al sistema que cubran necesidades no atendidas y con promesas de mejor salud y bienestar para los ciudadanos no puede ser visto como un problema. No obstante, la literatura especializada apunta a las innovaciones sanitarias como uno de los grandes motores del gasto sanitario, si no el principal, en las últimas décadas6. Nada indica que no seguirá siéndolo en el futuro (European Comission-Ageing Report, varios años). Por tanto, en un contexto de tratamientos cada vez más personalizados y de una demanda de precios muy elevados para los mismos, el desafío, incluso para países de rentas altas, es cómo financiarlos.
Además, aumentar el gasto en nuevas tecnologías no siempre merece la pena. En primer lugar, porque debe demostrarse la relación entre los recursos invertidos y el resultado obtenido. Asimismo, en relación al segundo aspecto, puede existir una amplia brecha entre la eficacia (resultado alcanzado en situaciones experimentales, “de laboratorio”, controladas) y la efectividad (resultado alcanzado en situaciones reales de práctica clínica habitual).
La mejor forma de despilfarrar los recursos con los que cuentan los sistemas de salud es financiando tecnologías, medicinas y procedimientos que no tengan una eficacia, efectividad y seguridad probadas. Utilizar tecnologías que son efectivas pero ineficientes también es un despilfarro. Y ello no sería solo ineficiente sino también inequitativo. Frente a la consideración simplista que pretende que en beneficio de un paciente se debe hacer todo lo que es posible hacer técnicamente, hay que tener en cuenta a los demás pacientes que podrían beneficiarse de dichos recursos. Expresado en otros términos, en el campo de las decisiones sanitarias, los costes de oportunidad no solo se miden en unidades monetarias, sino que, en numerosas ocasiones, se traducen más crudamente en salud perdida.
Por estos motivos, las autoridades sanitarias han de tener en cuenta a todos los pacientes presentes y futuros, de modo que los recursos se empleen en las intervenciones que generan mejores resultados en salud. La EETS es una herramienta fundamental para conseguirlo. Por ello es necesario que las nuevas tecnologías sean al menos tan buenas o mejores que las que ya existen y se usan en la práctica clínica habitual, aunque puede convenir la coexistencia de tecnologías sustitutivas en beneficio de la competencia.
El objetivo que debe cubrir la EETS es, pues, resolver los problemas de información imperfecta y asimétrica y de incertidumbre sobre la efectividad y servir de puente entre el campo de la investigación científico-técnica y el de la toma de decisiones, en un contexto de recursos limitados y múltiples necesidades. El cuadro 2 resume algunas de las ventajas de contar con un sistema formal de la evaluación de la eficiencia de tecnologías sanitarias.
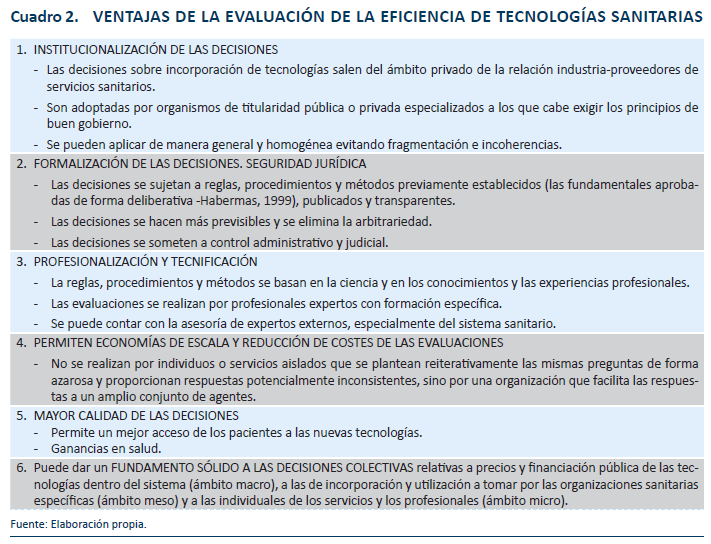
En este marco, merece la pena señalar que la EETS es un área científica y profesional muy activa y en plena expansión internacional, promovida por la necesidad de mejorar la asignación de los recursos y los procesos de toma de decisiones políticas. Su crecimiento también ha sido facilitado por el continuo desarrollo de nuevos métodos de evaluación en ciencias aplicadas. A comienzos de la década de los 90 del pasado siglo, Australia, en el año 1993, y la provincia canadiense de Ontario, en 1994, comenzaron a aplicar los criterios de eficiencia para informar las decisiones en los procesos de financiación pública y establecimiento de precios de medicamentos. Más tarde, en el año 1999, se sumaría la agencia NICE (National Institute for Health and Care Excellence, en su denominación actual), cuyo ámbito de competencias cubre Inglaterra y Gales. Esta organización es un paradigma y referente internacional en su ámbito por los principios rectores que rigen su actividad: autonomía, calidad metodológica, transparencia, procesos deliberativos y participativos y rendición de cuentas. Posteriormente, se unirían otros países como Suecia, Países Bajos, Portugal o Francia, en Europa, o Corea del Sur y Japón, en el Lejano Oriente.
Para finalizar esta contextualización cabe señalar que diversos informes de diagnóstico que se han realizado en los últimos años sobre nuestro Sistema Nacional de Salud apuntan a los problemas de buen gobierno o gobernanza del sistema. La falta de criterios y procesos claros para la mejora de la eficiencia de su desempeño son un ejemplo de ello (AES, 2013; Oliva, Peiró y Puig-Junoy, 2013). La buena gobernanza de los sistemas sanitarios debe apoyarse en valores fundamentales como son los derechos humanos y el cumplimiento de las normas, así como en principios rectores de nuestro sistema como son la universalidad, la equidad y la solidaridad. Pero estas normas deben ser complementadas por otros principios como sería el construir un sistema mucho más transparente en la información proporcionada a usuarios, profesionales y ciudadanos, más participativo en los debates y en la toma de decisiones, que desarrolle normas y estructuras concretas para que las personas responsables de la toma de decisiones rindan cuentas de las mismas y deban justificarlas basándose en criterios explícitos de efectividad, eficiencia y calidad (AES, 2013) (véase cuadro 3).
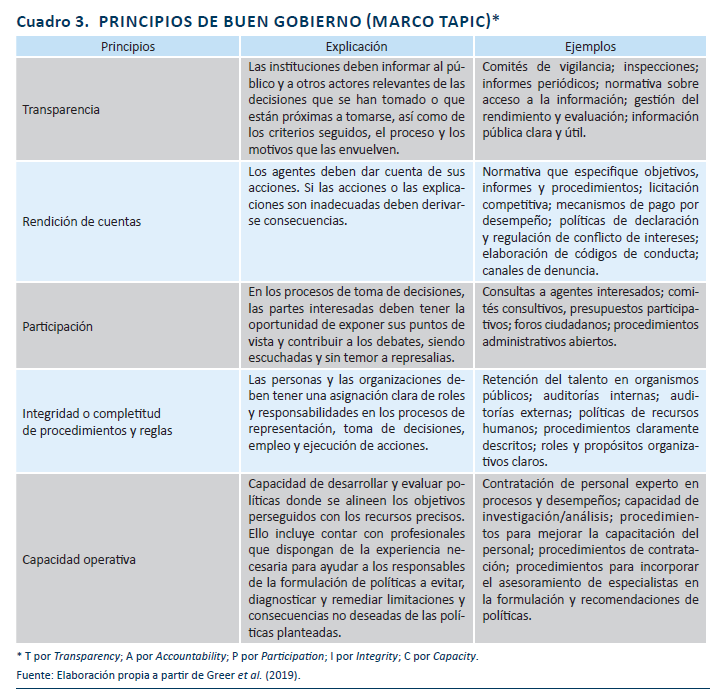
El desarrollo pleno de estructuras organizativas y procedimientos que ayuden a informar las decisiones incorporando la dimensión de eficiencia, bajo las premisas de la calidad técnico-científica, la transparencia en los procesos, la rendición de cuentas y la participación es una de las asignaturas pendientes de nuestro Sistema Nacional de Salud para garantizar de forma plena el derecho a la protección de la salud, como veremos en las páginas siguientes. A estas cuestiones organizativas y procedimentales de la evaluación de la eficiencia los mismos autores dedicamos otro documento de próxima publicación por Funcas.
2. BARRERAS Y CONDICIONANTES AL DESARROLLO DE LA EVALUACIÓN DE LA EFICIENCIA DE LAS TECNOLOGÍAS SANITARIAS EN ESPAÑA
Como se ha indicado, a comienzos de la década de los 90 del pasado siglo, Australia y Canadá comenzaron a aplicar los criterios de eficiencia en el proceso de establecimiento de precio y financiación pública de medicamentos. A este proceso se unieron otros países, muchos de ellos de nuestro entorno, pero también otros allende Europa.
Cuando Australia y Canadá avanzaban en sus procesos, España era pionera en varios aspectos relacionados con la EETS. Disponía de un buen número de investigadores reconocidos en el campo, había abordado propuestas de estandarización metodológicas (Antoñanzas y Rovira, 1993) y contaba con varias agencias específicas de evaluación de tecnologías sanitarias7, a partir de las cuales podría potenciarse el uso de la EETS en la toma de decisiones. Por tanto, la cuestión es: ¿por qué no despegó la EETS en España en ese momento o en años posteriores?
En este apartado señalaremos los obstáculos que dificultan la puesta en marcha de la evaluación de la eficiencia de las tecnologías sanitarias en España para las decisiones de financiación pública y fijación de precios. Los cuadros 4 y 4 bis recogen las barreras, identificadas en varias encuestas ad hoc por personas con capacidad de decisión en los niveles micro, meso y macro del ámbito sanitario, que dificultan la aplicación del criterio de eficiencia en la toma de decisiones sanitarias, así como sus sugerencias sobre los elementos que podrían favorecer un mayor uso de la evaluación económica. Entre ellas las hay de naturaleza política, jurídico administrativa, metodológicas y de aplicación práctica.


Por nuestra parte insistiríamos en la importancia de las barreras políticas (como el carácter polémico de la asignación de recursos escasos; el rechazo de las instancias políticas a perder el control sobre dichas decisiones de asignación de recursos escasos y la ausencia de modelos aplicables procedentes de otros sectores). También subrayaríamos el peso de una historia y una “cultura” prevalecientes en nuestro país en este ámbito que tienden a olvidar las exigencias de la limitación de recursos y la necesidad de marcar prioridades (Lobo, 2017). Podemos tomar como ejemplo, precisamente, la prestación farmacéutica. Desde fines de los años cincuenta del pasado siglo y con pocos matices, hasta no hace mucho, la financiación pública fue indiscriminada, alcanzando a todos los medicamentos comercializados. Dada la financiación generalizada de todos los productos en el mercado, la posibilidad de emplear criterios de eficiencia quedaba limitada únicamente a la intervención de precios. Esta “generosidad” de la prestación farmacéutica, que ha perdurado sesenta años, hace difícil, incluso ahora, encontrar apoyo entre los políticos, en el medio sanitario y en la opinión pública, al uso de herramientas económicas para guiar estas decisiones que pueden implicar la denegación de financiación pública (Lobo, 2013). Esto implica la resistencia de muchos de los agentes sociales y profesionales, incluyendo altos cargos de la Administración sanitaria, quienes han confundido, por ignorancia o por conveniencia, principios económicos esenciales como la eficiencia o el coste de oportunidad tildándolos de “economicistas”.
Entre las mencionadas en los cuadros 4 y 4 bis por los decisores sanitarios, las barreras que tienen que ver con una insuficiencia de recursos económicos y de personal y con un mal diseño de los incentivos profesionales y organizativos también nos parecen de gran importancia.
En todo caso, todas estas barreras terminan por reflejarse en la insuficiencia normativa, que es la barrera que sintetiza todas las demás y que consideramos más determinante, por lo que se analizará en detalle en el apartado tercero de este trabajo.
Asimismo, debemos señalar que España no ha sido el único país en afrontar barreras en la aplicación del criterio de eficiencia en la toma de decisiones sanitarias. En un estudio realizado en varios países europeos a finales de la década de los 90 del pasado siglo, las barreras identificadas en España fueron idénticas a las de otros países (Hoffman y Graf von der Schulenburg, 2000). Por tanto, la cuestión no es tanto la existencia de los obstáculos identificados, sino comprender los motivos de nuestra incapacidad para su superación que nos sitúa lejos de países de nuestro entorno como Inglaterra, Francia, Alemania o Suecia (Epstein y Espín, 2020).
3. EVOLUCIÓN DEL RÉGIMEN JURÍDICO DE LA EVALUACIÓN DE LA EFICIENCIA DE LAS TECNOLOGÍAS SANITARIAS: UNA REGULACIÓN FRAGMENTADA, ASISTEMÁTICA, DISCONTINUA, PARCIAL E INSUFICIENTE
3.1. El marco jurídico y organizativo
¿Propicia el marco jurídico en España el uso del criterio de eficiencia en la asignación de recursos públicos? Como punto de partida debe tenerse en cuenta que se trata de un principio que figura en la Constitución de 1978, cuyo artículo 31.2 dispone que “El gasto público realizará una asignación equitativa de los recursos públicos, y su programación y ejecución responderán a los criterios de eficiencia y economía”. Dicho principio se concreta, con carácter general, en la Ley 47/2003, de 26 de noviembre, General Presupuestaria, que en su artículo 72, indica que “El Ministerio de Hacienda, en colaboración con los distintos centros gestores de gastos, impulsará y coordinará la evaluación continuada de las políticas de gasto con la finalidad de asegurar que las mismas alcancen sus objetivos estratégicos y el impacto socioeconómico que pretenden”. Más recientemente, y como consecuencia de la penúltima crisis económica, la Ley Orgánica 2/2012, de 27 de abril, de Estabilidad Presupuestaria y Sostenibilidad Financiera introdujo en el artículo 7 el principio al exigir que “La gestión de los recursos públicos estará orientada por la eficacia, la eficiencia, la economía y la calidad, a cuyo fin se aplicarán políticas de racionalización del gasto y de mejora de la gestión del sector público”. Por tanto, existe un marco general que exige considerar el criterio de eficiencia en la asignación de recursos públicos y que propicia la evaluación de las políticas de gasto público, si bien resulta excesivamente genérico y abierto.
Dentro del ámbito sanitario, a lo largo de los años, se ha producido un desarrollo normativo y de programación que recogemos en el cuadro 5. La Ley 14/1986 General de Sanidad, de 25 de abril (LGS 1986), en su artículo 110 estableció el innovador principio de que: “Corresponde a la Administración Sanitaria del Estado valorar la seguridad, eficacia y eficiencia de las tecnologías relevantes para la salud y la asistencia sanitaria”. Sin embargo, fue un precepto poco efectivo pues se limitaba a hacer una simple atribución de competencias sin concretar su contenido ni anudar consecuencias prácticas a los resultados de la evaluación8.
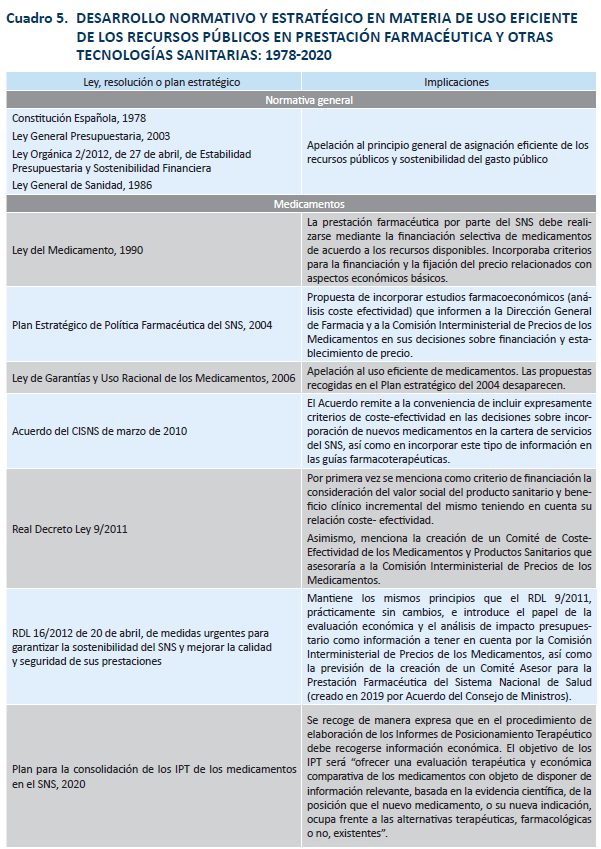
Por lo que se refiere a los medicamentos, existía una financiación indiscriminada, como ya se ha indicado, en tanto se permitía prescribir los que fueran convenientes para la recuperación de la salud de los pacientes, por lo que, en último término, eran los facultativos quienes determinaban la financiación de los medicamentos (Vida, 2017)9. Al principio contrario, o de la financiación selectiva, es decir, la posibilidad de que no todos gocen de financiación pública, se aproximó la Ley General de Sanidad de 1986 en su disposición adicional quinta, que sigue en vigor, aunque no utilizó esta denominación y sólo tuvo limitada aplicación años después con los reales decretos de listas negativas10.
El principio de “financiación selectiva y no indiscriminada” sería explícitamente confirmado por la Ley 25/1990 del Medicamento, que utilizaba esa expresión en su Exposición de Motivos y lo concretó en su artículo 94 estableciendo que “en el momento de autorizar y registrar una especialidad farmacéutica se decidirá, además, si se incluye, modalidad en su caso, o se excluye de la prestación farmacéutica…”. Dicha Ley avanzó, pues, en la senda de exigencia de la eficiencia, aunque sin llegar a expresarla satisfactoriamente, pero iniciando un cambio en los fundamentos legales de la prestación farmacéutica y sentando los criterios que regirían su ordenación a partir de entonces (Vida, 2017). Por una parte, la idea de la limitación del contenido de la prestación farmacéutica que no puede incluir a todos los medicamentos autorizados y registrados; y, por otra, que la selección de los medicamentos debe llevarse a cabo tanto con criterios terapéuticos como económicos. Sin embargo, no se llegó a concretar y desarrollar cómo debía operar el requisito de la eficiencia, que permanecía vinculado a unos criterios de financiación muy básicos11.
3.2. El desarrollo de la evaluación de la eficiencia de las tecnologías sanitarias distintas de los medicamentos
Una de las características más notables en el tratamiento jurídico de la evaluación de la eficiencia de las tecnologías sanitarias es que los cauces y procedimientos sobre incorporación y financiación pública se establecen de manera diferente en el caso de los medicamentos y del resto de las tecnologías sanitarias.
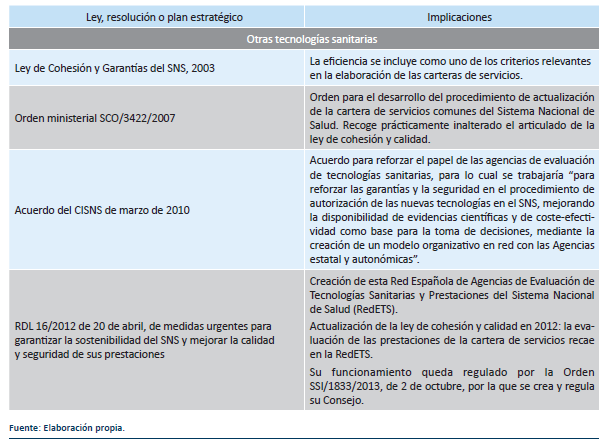
La Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud (LCCSNS), diecisiete años después de la LGS 1986, en sus artículos 20 y 21, dedicados al desarrollo de la cartera de servicios del SNS, claramente condiciona la incorporación de tecnologías para su financiación pública a que cumplan el requisito de eficiencia y permite su exclusión por el mismo motivo. Además, estableció que “las nuevas técnicas, tecnologías o procedimientos serán sometidas a evaluación con carácter previo a su utilización en el SNS por… la Agencia de Evaluación de Tecnologías Sanitarias…” (artículo 21)12.
En la modificación de la LCCSNS efectuada por el Real Decreto Ley 16/2012 (RDL 16/2012), de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones (RDL 16/2012), se añadió que “En la evaluación… participará la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud”, es decir las agencias de las CC. AA. (artículo 8 quinquies). Asimismo, se dispuso que el Ministerio de Sanidad realice anualmente una evaluación de los costes de aplicación de la cartera común de servicios del SNS (art. 8.4 LCCSNS).
El desarrollo reglamentario de la LCCSNS concretó la aplicación del principio de eficiencia. El Real Decreto 1030/2006, de 15 de septiembre, que establece la cartera común de servicios del SNS y su actualización y la Orden SCO/3422/2007, de 21 de noviembre, regulan estos procedimientos en detalle (Vida, 2004 y 2011). Desde el año 2012, la Comisión de Prestaciones, Aseguramiento y Financiación coordina las demandas de evaluación de nuevas tecnologías, para lo cual se ha diseñado una herramienta de priorización (PriTEC) (Varela-Lema, Atienza-Merino y López-García, 2017). La citada Comisión eleva al CISNS las propuestas de actualización de cartera, considerando los informes realizados por las AETS. Según señala un artículo reciente, “Los dominios que normalmente se evalúan son la eficacia, la efectividad, la seguridad, los aspectos organizativos, los aspectos éticos y el coste efectividad. En ocasiones, los encargos incluyen explícitamente una evaluación económica. La importancia del contenido económico en los informes ha ido aumentando con el tiempo, e incluye no solo evaluaciones económicas completas, sino también análisis de costes, impacto presupuestario y revisiones sistemáticas de evaluaciones económicas” (Giménez et al., 2020). De hecho, en dicho trabajo también se indica que, de 439 informes realizados por la RedETS, 174 incluían aspectos económicos y 72 realizaban evaluaciones completas. De 25 evaluaciones económicas realizadas en el periodo 2006-2016 y analizadas en detalle se extrajeron 19 ratios de coste-efectividad incremental correspondiente a 15 análisis coste-utilidad de productos sanitarios. 15 tecnologías fueron incluidas en la cartera de servicios y 4 no fueron incluidas. Los autores también señalan que la mayoría de las evaluaciones analizadas cumplían con los criterios de calidad marcados para su elaboración (estos criterios se recogen en López-Bastida et al., 2010).
La crisis económica desencadenada a partir de 2008, exacerbó la necesidad de aplicar criterios de eficiencia en la asignación de unos recursos sanitarios siempre escasos. En marzo del año 2010, ya reconocida la gravedad de la crisis económica, el Consejo Interterritorial del Sistema Nacional de Salud (CISNS) acordó una serie de “Acciones y medidas para promover la calidad, la equidad, la cohesión y la sostenibilidad del Sistema Nacional de Salud” (CISNS de 18 de marzo de 2010), entre ellas potenciar el papel de las agencias de evaluación de tecnologías sanitarias. Se trabajaría “para reforzar las garantías y la seguridad en el procedimiento de autorización de las nuevas tecnologías en el SNS, mejorando la disponibilidad de evidencias científicas y de coste-efectividad como base para la toma de decisiones, mediante la creación de un modelo organizativo en red con las Agencias estatal y autonómicas”.
La Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud (RedETS) fue establecida por el RDL 16/2012. La RedETS está formada por organismos, órganos y unidades de evaluación tanto estatales como autonómicos cuyo objetivo es desarrollar una evaluación independiente, participativa y transparente bajo un marco metodológico común, sujeta a revisión por expertos externos, y basado en el mejor conocimiento científico disponible13. El Consejo de la RedETS, actúa como órgano colegiado de asesoramiento científico-técnico del SNS y está formado por las personas titulares de las direcciones de las agencias o unidades de evaluación de las agencias bajo la coordinación del Ministerio de Sanidad. Actualmente el Plan de Recuperación, Transformación y Resiliencia ha permitido incrementar su asignación presupuestaria y está previsto dotarla de personalidad jurídica.
Estructuralmente puede defenderse que la organización de la red y su regulación han sido estimables, pero su nivel de actividad real en materia de evaluación de la eficiencia podría ser superior al descrito. En este sentido, hay que puntualizar que la actividad de las AETS no se circunscribe únicamente a los informes económicos de evaluación de la eficiencia14. De hecho, este tipo de informes son generados habitualmente a demanda, bien de la citada Comisión de Prestaciones, Aseguramiento y Financiación, bien de la Administración autonómica del que depende cada AETS, bien como parte de proyectos de investigación financiados por proyectos europeos, del Fondo de Investigación en Salud, o de otras fuentes. En todo caso, una visita por las páginas webs de las mencionadas agencias o una visita a su listado de informes publicados15 parecen indicar que las evaluaciones económicas son una parte minoritaria de su actividad, y concentrada en AETS concretas16.
3.3. El desarrollo de la evaluación de la eficiencia de los medicamentos
El Plan Estratégico de Política Farmacéutica para el SNS del año 2004 del Ministerio de Sanidad, (Ministerio de Sanidad y Consumo, 2004) establecía que la evaluación económica (análisis coste-efectividad) debía ser una pieza clave para apoyar las decisiones y desarrollaba sus procedimientos. A pesar de este antecedente, llamó poderosamente la atención la práctica ausencia de referencias a la evaluación económica en la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios (LGURM 2006) (Antoñanzas et al., 2007; Agencia de Calidad y Evaluación, 2007; Lobo, 2013). Y más, cuando, como hemos visto, casi en paralelo había sido establecida poco antes para las tecnologías no medicamentosas en la LCCSNS 2003. La LGURM en su versión original solamente mencionaba la palabra “eficiencia” en la exposición de motivos y en su regulación de los servicios de farmacia, aunque sí recoge la dimensión económica dentro del principio de financiación selectiva como ya ocurría en la LM17.
La Gran Recesión (crisis económica que afectó, entre otros, a España durante el periodo 2008-2014), como se ha apuntado ya, redobló la necesidad de contar con una evaluación económica de los medicamentos desarrollada sistemáticamente, pero las expectativas iniciales se verían defraudadas. El Acuerdo del Consejo Interterritorial del SNS de 18 de marzo de 2010 ya mencionado, consideraba “conveniente que la incorporación de nuevos medicamentos en la cartera de servicios del SNS ha de basarse en criterios de coste-efectividad, así como trabajar de manera conjunta para desarrollar Guías fármaco-terapéuticas que ayuden a que las decisiones clínicas se fundamenten en criterios de evidencia y coste-efectividad”.
Siguieron importantes modificaciones legislativas frente a la crisis que afectaron sustancialmente a la prestación farmacéutica. Se concretaron en una batería de reales decretos ley, promulgados entre 2010 y 2012, y en 2013 en una ley más18. No obstante, como veremos, no consiguieron una regulación satisfactoria.
Por lo que se refiere a la inclusión de medicamentos en la prestación farmacéutica, el Real Decreto Ley 9/2011, de 19 de agosto, de medidas para la mejora de la calidad y cohesión del Sistema Nacional de Salud (RDL 9/2011) introdujo la innovación legislativa más importante en materia de evaluación de la eficiencia de los medicamentos en nuestro país19. En efecto, modificó el artículo 89 de la LGURM 2006 retomando el concepto de financiación selectiva y añadiendo como criterios generales “a tener en cuenta” para la inclusión de medicamentos en la financiación del Sistema Nacional de Salud los siguientes (en cursiva las modificaciones respecto de la LGURM 2006 original):
- c) Valor terapéutico y social del medicamento y beneficio clínico incremental del mismo teniendo en cuenta su relación coste- efectividad.
- d) Racionalización del gasto público destinado a prestación farmacéutica e impacto presupuestario en el Sistema Nacional de Salud.
- e) Existencia de medicamentos u otras alternativas terapéuticas para las mismas afecciones a menor precio o inferior coste de tratamiento.
El criterio c) remite a la eficiencia. El criterio d) remite a la necesidad de analizar y valorar el impacto presupuestario, que es complemento ineludible de los estudios de evaluación de la eficiencia en sentido estricto.
En cuanto a la evaluación económica en el ámbito de la intervención de precios, el RDL 9/2011 también modificó el apartado 3 del artículo 90 LGURM para disponer que la Comisión Interministerial de Precios de los Medicamentos (CIPM) tuviera en consideración los informes del Comité de Coste-Efectividad de los Medicamentos y Productos Sanitarios, órgano de nueva creación, que no llegó a ver la luz20. Y reparemos también en que la CIMP (según el artículo 90.2 LGURM original) tenía que basarse en los criterios del artículo 89 LGURM, y entre ellos el c), recién mencionado.
Por tanto, la LGURM, en la nueva redacción de 2011, ordenaba ya a la Administración que, de alguna manera, había de contar con estudios de la eficiencia (la ley usa el anglicismo “coste-efectividad”) para las decisiones de financiación y de precios.
Esta regulación fue pronto retocada por el RDL 16/2012, que también incluyó referencias a posibles estudios de evaluación de la eficiencia como apoyo de las decisiones. En concreto son dos. En primer lugar, el nuevo artículo 89 bis LGURM (sobre criterios fundamentales de inclusión en la prestación farmacéutica) establece que “la Comisión Interministerial de Precios de los Medicamentos tendrá en consideración los análisis coste-efectividad y de impacto presupuestario”. En segundo lugar, el artículo 90 LGURM (sobre fijación de precios) dispone que: “7. Para la toma de decisiones, la Comisión Interministerial de Precios de los Medicamentos tendrá en consideración los informes que elabore el Comité Asesor para la Financiación de la Prestación Farmacéutica del Sistema Nacional de Salud (CAPF)”21. Sin embargo, la creación de dicho Comité se demoró casi siete años, hasta el 1 de abril de 2019.
¿Qué valor se puede asignar a estas novedades de los RDL de crisis? Cabe señalar que aunque fueran innovaciones importantes, ello no quiere decir que fueran satisfactorias. Los preceptos indicados no llegan a concretarse en la propia LGURM y tampoco han sido desarrollados por disposiciones reglamentarias hasta la actualidad. Son un paso adelante, pues aparecen en una norma con rango de ley los criterios de eficiencia, tanto para la financiación pública como para las decisiones de precios, pero sigue tratándose de una regulación confusa y poco sistemática. En este sentido, es importante indicar que persiste la ambigüedad. Se utilizan expresiones muy vagas (“tener en consideración” o “tener en cuenta”, “estudios que pueda elaborar”). Lo único que se ordena es que la CIMP tenga en consideración los informes de este tipo. Por tanto, se echan en falta mandatos claros que obliguen a las empresas a presentar estudios de este tipo, y tampoco se ordena claramente a la Administración que los revise o los efectúe ella misma. No se configura, pues, la evaluación como un derecho o garantía para las empresas ni, sobre todo, para los ciudadanos y no se ofrece una mínima estructura metodológica ni garantías para las empresas y para los pacientes, es decir, no se implementó de manera efectiva una nueva garantía (demostrar la eficiencia) para incorporar un nuevo medicamento a la prestación farmacéutica (González López-Valcárcel, 2022) o, al menos, no se encuentra bien definida (Epstein y Espín, 2020). Por último, cabe destacar que la referencia al “beneficio clínico incremental” fue afortunada, pues se trata de un criterio fundamental, pero hubiera exigido una definición y desarrollo detallados y que no hubo previsión de nuevos fondos presupuestarios ni de contratación de personal experto adicional, lo cual lastraba su desarrollo y aplicación práctica.
No es extraño, por tanto, que después de la promulgación del RDL 16/2012 no se apreciaran progresos. Pronto voces expertas proclamaron su escepticismo (Cabiedes, 2012 y 2013). Siguieron varios informes oficiales de la Comisión Nacional de los Mercados y la Competencia (CNMC, 2015a y 2015b), del Tribunal de Cuentas (2017) y de la Autoridad Independiente de Responsabilidad Fiscal (2018, 2019), quienes señalaron la falta de transparencia en materia de financiación y establecimiento del precio del medicamento por parte del Ministerio de Sanidad y de la CIPM. Asimismo, se sumaron las voces críticas de sociedades científicas y profesionales, como la Organización Médica Colegial o la Sociedad Española de Salud Pública y Administración Sanitaria-SESPAS (OMC, 2014; SESPAS, 2017). Estas llamadas de atención no tuvieron éxito alguno.
3.4. Valoración de conjunto de la evolución de la regulación de la evaluación de la eficiencia de los medicamentos y de otras tecnologías sanitarias
Llegados a este punto, cabe señalar que la regulación y organización de la evaluación de la eficiencia de los medicamentos y de otras tecnologías sanitarias, especialmente de los primeros, ha sido (i) fragmentada, puesto que se ha desarrollado de forma separada y estanca para medicamentos y las demás tecnologías sanitarias; (ii) asistemática, dado que se materializa de forma dispersa y vaga, sin contar con un desarrollo reglamentario coherente que lo haya concretado; (iii) discontinua, puesto que la regulación se ha producido a trompicones, con más estancamientos que avances, introduciéndose algunas novedades que tardaban años en desarrollarse; (iv) parcial, ya que solamente se han regulado ciertos aspectos por lo que no existe una metodología ni un procedimiento ni, en definitiva, un sistema que permita realizar adecuadamente una evaluación de la eficiencia; y (v) insuficiente, puesto que el marco normativo existente no concreta cómo debe realizarse la valoración de la eficiencia y la organización administrativa competente carece de los medios necesarios para implementarla.
En suma, el criterio de eficiencia aparece expresamente en la normativa del medicamento desde 2011, pero de manera escueta, sin el marco necesario. La falta de concreción y desarrollo normativo, así como de un respaldo organizativo y presupuestario ha impedido el desarrollo y consolidación de lo que aparecía en la normativa como un principio general deseable (recomendamos volver a revisar el cuadro 2). De este modo, no se daba una aplicación práctica sistemática y generalizada del criterio de eficiencia que permitiera afirmar que se trataba de un principio esencial en la determinación del contenido de las prestaciones sanitarias. De hecho, resultaba imposible conocer el peso que tenía la eficiencia como criterio en la decisión de financiación y fijación del precio de los medicamentos y si la CIPM tomaba sus decisiones considerando dicho criterio o no.
Así, la puerta se dejaba medio abierta, pero los decisores de mayor nivel no manifestaban una señal clara sobre cómo emplear este criterio. Esta indefinición tuvo como resultado que, más allá del discurso oficial, las decisiones en materia de eficiencia se trasladaban al nivel de la meso e incluso de la microgestión, lo cual no deja de ser paradójico, ateniéndonos al ejemplo observado en otros países (Drummond, 2002; Oliva, Antoñanzas y Rivero-Arias, 2008; Paris y Belloni, 2013; Abellán-Perpiñán y Martínez-Pérez, 2016). De este modo, las barreras para la aplicación de elementos de eficiencia en el sistema, analizadas en el epígrafe dos, han permanecido prácticamente inalteradas en décadas, mientras que otros países europeos, con barreras iniciales similares, avanzaban en la incorporación de la EETS como herramienta clave en la ayuda de la toma de decisiones (Zozaya et al., 2022)
4. LA PRÁCTICA EN LA EVALUACIÓN DE LA EFICIENCIA DE LAS TECNOLOGÍAS SANITARIAS
A partir de la evolución experimentada por la normativa sobre la evaluación de la eficiencia de las tecnologías sanitarias en nuestro país, pudiera parecer que en España la actividad centrada en las EETS es apenas marginal. Nada más lejos de la realidad. Los estudios de revisión de la actividad española en el campo de la EETS revelan una tendencia creciente en el número de trabajos realizados (Oliva, del Llano y Sacristán, 2002; Catalá-López y García-Altés, 2010), si bien con un importante margen de mejora metodológica (Sanz-Granda et al., 2013; Catalá-López et al., 2016; Ridao y Catalá-López, 2016), con debates similares a los que se reproducen a nivel internacional sobre aspectos controvertidos en materia de EETS sobre los que no hay consenso (Oliva et al., 2015; Trapero-Bertran et al., 2015; Espín et al., 2015), y también con problemas comunes a otros países sobre los que debe actuarse para mejorar la credibilidad de este tipo de análisis (Catalá-López y Ridao, 2016; Catalá-López y Ridao, 2017).
Esta actividad ha sido mantenida por varios tipos de agentes, públicos y privados. En primer lugar, por las siete agencias autonómicas de evaluación de tecnologías sanitarias más la agencia estatal que se coordinan a través de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud22. La actividad de estas agencias consiste en informes de evaluación de tecnologías sanitarias (registrados en un repositorio de libre acceso23), en la elaboración de documentos de apoyo metodológico en su campo, incluyendo la evaluación económica (López-Bastida y Oliva (coord.), 2008; López-Bastida et al., 2010) y los recientes trabajos centrados en la estimación del valor del Año de Vida Ajustado por Calidad (Vallejo-Torres et al., 2014, 2015 y 2016), y en la generación de guías de práctica clínica. También participan en la Red Internacional de Agencias de Evaluación de Tecnologías Sanitarias (INAHTA-The International Network of Agencies for Health Technology Assessment), en la Red Europea de Evaluación de Tecnologías Sanitarias (EUnetHTA-European network for Health Technology Assessment) y en la Red Europea de Cooperación en Evaluación de Tecnologías Sanitarias (HTA Network). Un ejemplo de la actividad de estas agencias es el estudio de Giménez et al., 2020, donde se revisan 25 evaluaciones económicas realizadas en el periodo 2006-2016 de tecnologías sanitarias no medicamentosas (cribados, procesos quirúrgicos e intervenciones preventivas). Estos estudios son trasladados a la Comisión de Prestaciones, Aseguramiento y Financiación, que los tiene en consideración para elevar al Consejo Interterritorial del Sistema Nacional de Salud24 propuestas de actualización de la cartera de servicios sanitarios.
En segundo lugar, y dentro de los actores públicos, se debe mencionar la actuación del Comité Mixto de Evaluación de Nuevos Medicamentos formado por Andalucía, Cataluña, País Vasco, Navarra, Aragón y Castilla y León. Este Comité evalúa la aportación terapéutica que supone la comercialización de nuevos medicamentos en relación con las alternativas disponibles en el momento, considerando los criterios de eficacia, seguridad, aplicabilidad y coste a través de un Procedimiento Normalizado de Trabajo, con objeto de proporcionar a los profesionales sanitarios recomendaciones sobre su uso. También dentro de los actores públicos cabe destacar la actividad desarrollada por la Comissió d’Avaluació Econòmica i d’Impacte Pressupostari (CAEIP) del Servei Català de la Salut (CatSalut), que promovió, hasta su desaparición en el año 2019, una constante actividad en el campo de la evaluación económica y fomentó el uso de esta herramienta para la toma de decisiones en su medio. Entre sus actividades destaca la elaboración de una guía para la definición de criterios de aplicación de fórmulas de pago basadas en resultados en el ámbito fármaco-terapéutico (Segú-Tolsa, Puig-Junoy y Espinosá-Tomé (coord.), 2014) y una guía y recomendaciones para la realización y presentación de evaluaciones económicas y análisis de impacto presupuestario de medicamentos en el ámbito del CatSalut (Puig-Junoy et al., 2014). El objetivo buscado era incorporar la información proporcionada por las evaluaciones económicas en la toma de decisiones de los procesos de posicionamiento y compra de medicamentos por parte del CatSalut. Aunque el proyecto llegó a una fase de pilotaje, finalmente no se llevó a término. Asimismo, se debe mencionar el Plan de Salud de Canarias 2004-2008, de alcance regional, donde se realiza un análisis complementario de la carga de la enfermedad y del impacto económico para identificar los problemas que más afectan a la salud de las personas residentes en las Islas Canarias y donde se incorporan en nuestro país por primera vez de manera explícita los criterios coste-efectividad en la planificación de recursos sanitarios (Servicio Canario de la Salud, 2004)25.
En tercer lugar, cabe destacar las actividades desarrolladas bajo el amparo de sociedades profesionales y científicas. Así, el grupo GENESIS –Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de medicamentos– dentro del marco de la Sociedad Española de Farmacia Hospitalaria, ha desarrollado una muy relevante actividad de evaluación de medicamentos en los últimos años, incorporando con frecuencia consideraciones económicas y desarrollando su propia guía metodológica (Ortega Eslava et al., 2017), aunque sus métodos, en la parte de evaluación de la eficiencia, no han estado exentos de críticas cuando se han comparado con los estándares de guías de otros países (González López-Varcarcel, 2022). Por su parte, la Asociación de Economía de la Salud (AES) es un punto de encuentro de personas con interés en la Economía de la salud y específicamente la evaluación de la eficiencia. Anualmente en las Jornadas de Economía de la Salud se presentan numerosos trabajos de EETS aplicados y avances metodológicos. Cuenta con un grupo de trabajo específico en este campo (EEconAES) y genera un continuado debate sobre la relevancia de incorporar la evaluación económica y el criterio de eficiencia de manera más decidida en los procesos de toma de decisiones sanitarias (AES, 2008; AES, 2009; Bernal et al., 2011; AES, 2013).
Asimismo, se debe subrayar el importante papel de la industria farmacéutica y de productos sanitarios y de consultoras especializadas en la realización de trabajos de evaluación económica. De hecho, una importante proporción de los trabajos realizados en las dos últimas décadas han sido financiados con fondos privados, principalmente por la industria farmacéutica, y el número de empresas consultoras y su actividad ha crecido de manera apreciable.
Cabe destacar igualmente el papel de los investigadores que desarrollan su actividad en la universidad. Son autores de evaluaciones económicas aplicadas, pero también investigan nuevas herramientas e instrumentos que mejoran la calidad de los métodos aplicados a este campo (Abellán Perpiñán, Sánchez Martínez y Martínez Pérez, 2009), desarrollan guías de buenas prácticas o contribuyen al debate sobre la utilidad de la EETS en la toma de decisiones.
Hemos visto pues, en España, un panorama de actividad creciente en la práctica de la evaluación de la eficiencia de las tecnologías sanitarias, con un número de actores considerable y con gran heterogeneidad en la calidad de los trabajos desempeñados y en los intereses de los propios actores. Parece claro que existen enormes posibilidades de coordinación de toda esta actividad, no aprovechadas más que de manera muy parcial.
5. ÚLTIMOS AVANCES Y ESTADO ACTUAL DE LA EVALUACIÓN DE LA EFICIENCIA DE LAS TECNOLOGÍAS SANITARIAS
Como señalamos anteriormente, el régimen jurídico de la prestación farmacéutica incorpora el criterio de eficiencia (coste-efectividad) y los análisis de impacto presupuestario como elementos que deben ser tomados en consideración tanto para la decisión sobre financiación pública de medicamentos como para el establecimiento del precio. No obstante, hemos visto que la regulación es gravemente insuficiente y que no es claro el peso que estos criterios desempeñaban en las decisiones finales e, incluso, si éstos eran considerados de manera alguna26.
En los últimos años esta situación está cambiando y en la estrategia del Ministerio de Sanidad se ha dado prioridad a la evaluación de la eficiencia de las tecnologías sanitarias, especialmente visible en el caso de los medicamentos como se refleja en un reciente documento informativo sobre la financiación y fijación del precio de los medicamentos en España (Ministerio de Sanidad, 2022). Este cambio se puede apreciar en cuatro hechos destacables.
En primer lugar, el 22 de marzo de 2019, el Consejo de Ministros acordó, a propuesta del Ministerio de Sanidad, la creación del Comité Asesor para la Financiación de la Prestación Farmacéutica del Sistema Nacional de Salud y mediante Orden ministerial de 1 de abril de 2019 se nombró a sus miembros. El cometido de este órgano colegiado, de carácter científico-técnico, es “proporcionar asesoramiento, evaluación y consulta sobre la pertinencia, mejora y seguimiento de la evaluación económica necesaria para sustentar las decisiones de la Comisión Interministerial de Precios de los Medicamentos”27. La actividad de este Comité durante sus dos primeros años de vida ha incluido informes sobre el “Plan de acción para fomentar la utilización de los medicamentos reguladores del mercado en el SNS: medicamentos biosimilares y medicamentos genéricos”, sobre la necesidad de reforma de los copagos que recaen sobre los medicamentos con receta o sobre la nueva estrategia en materia de informes de posicionamiento terapéutico (IPT)28, a la que nos referiremos a continuación. Todas estas actividades han sido desarrolladas sin que el Comité cuente con una estructura y medios suficientes ya que fue creado con el compromiso de no incrementar el gasto presupuestario.
En segundo lugar, desde la sesión 187 del 30 noviembre de 2018, la Comisión Interministerial de Precios de los Medicamentos (CIPM) publica en sus actas el precio industrial máximo establecido para los fármacos financiados públicamente. Asimismo, desde la sesión 190 del 25 de abril de 2019, se incorpora una breve reseña justificativa que hace referencia al criterio o criterios marcados por la Ley que han conducido a una propuesta favorable o desfavorable de precio y financiación. Aunque la información es mínima y no incorpora informes adicionales, supone ya un avance respecto a la situación de años anteriores.
En tercer lugar, se encuentra la creación, en 2013, y desarrollo posterior de los informes de posicionamiento terapéutico (IPT). La evaluación de la seguridad, eficacia y calidad de los medicamentos en el marco de los procedimientos de autorización de comercialización tradicionalmente se ha centrado en el balance riesgo/beneficio del medicamento individual, sin entrar en comparaciones que determinasen el valor añadido (posicionamiento) del medicamento nuevo respecto de los tratamientos existentes. Por otro lado, las Comunidades Autónomas, responsables de la gestión de los servicios sanitarios, tienen que establecer prioridades y recomendaciones de uso acerca de la incorporación efectiva de los medicamentos a la práctica asistencial, lo que exige una valoración comparativa. Así, en ocasiones se han producido diferencias y contradicciones acerca del valor terapéutico de los medicamentos y recomendaciones dispares para su uso clínico. Se ha generado así confusión, desconfianza de los profesionales y de los pacientes y también problemas de equidad geográfica.
Para remediarlo y lograr una valoración unitaria de la efectividad de un medicamento, la Comisión de Farmacia del Consejo Interterritorial de Salud aprobó en mayo de 2013 la elaboración de los IPT, consagrados como vinculantes por la Ley 10/2013 (disposición adicional tercera). Los IPT son relevantes para la evaluación económica, primero porque en este tipo de análisis en uno de sus platillos se encuentran los costes, pero en el otro están la eficacia/efectividad y la seguridad (“La efectividad relativa es un concepto clave para la evaluación del Valor y por consiguiente para las decisiones sobre precios y financiación pública”, Jöhnson, 2011). Segundo, porque en la actualidad se contempla que los IPT pueden incluir la evaluación económica, a diferencia de lo que ocurría anteriormente. Inicialmente resultó confuso si debía ser así (Lobo, 2013) y en la práctica la dejaban fuera del análisis. Por tanto, se adoptaba una visión sobre el valor del medicamento enfocada únicamente en la terapéutica, obviando otros conceptos de valor más amplio, que consideran también los recursos necesarios para su financiación y su uso racional y no se integraban en un único proceso evaluador la parte clínica y la económica.
Los IPT son una herramienta claramente útil para evaluar el valor clínico comparado de un medicamento y pueden considerarse un elemento muy positivo en materia de coordinación y para añadir coherencia a las decisiones de uso del medicamento dentro del marco del SNS. Afortunadamente, el Plan para la consolidación de los informes de posicionamiento terapéutico de los medicamentos en el Sistema Nacional de Salud, de 2020, previó incorporar de manera expresa en dichos informes la evaluación económica de los medicamentos. Según señala: “El objetivo general del presente Plan es consolidar los IPT de los medicamentos como el instrumento de referencia para el posicionamiento y la evaluación económica del coste-efectividad de los medicamentos en el SNS como herramienta de referencia…”. El encargado de realizar la evaluación económica, según el plan, es “un equipo de la Dirección General de Cartera y Farmacia, apoyado por aquellas designaciones que se realicen por las CC. AA.” en el marco de una red de las administraciones y expertos conformada bajo el nombre de Red de Evaluación de Medicamentos del SNS – REvalMed, “tejida por las alianzas entre la DGCYF, la AEMPS y las CC. AA.” y recibiendo información procedente de las empresas que deseen comercializar el medicamento (Ministerio de Sanidad, 2020)29. Para ello, se seguirá un “Procedimiento normalizado de trabajo de evaluación clínica, evaluación económica y posicionamiento terapéutico…”30. Aunque el plan en la parte económica suscita dudas por lo que respecta a aspectos organizativos, metodológicos formales y tiempos de realización, en el momento de escribir este texto ya se han publicado los primeros IPT que incorporan la parte de la evaluación económica en el proceso.
En relación con el párrafo anterior, cabe señalar dos elementos de reflexión. En primer lugar, antes de la puesta en marcha de los nuevos IPT, el Comité Asesor para la Financiación de la Prestación Farmacéutica del SNS emitió un documento donde se recogen propuestas de mejora y concreción del plan que abarcan aspectos legales, profesionales, de buen gobierno y metodológicos. El segundo de ellos es la marcada heterogeneidad en los métodos empleados en los primeros IPT publicados que incorporan evaluaciones económicas. Mientras que en unos casos parecen adoptarse unos métodos que serían fácilmente homologables a los aplicados por agencias de evaluación de otros países, en otros casos la parte económica no deja de ser un mero cálculo de coste por tratamiento y paciente o se reconoce abiertamente que su realización es inviable. Ello también plantea dudas sobre si las empresas presentan sus informes de evaluación económica al Ministerio y si, en tal caso, los mismos son tenidos en cuenta en la elaboración del IPT. En días previos a la finalización de este documento, se publicaba un informe de la Comisión Nacional de los Mercados y la Competencia que expresaba ideas similares31.
Por tanto, podemos señalar que los nuevos IPT se encuentran en fase de rodaje, pero ya con elementos de mejora identificados claramente desde su inicio y aún queda por comprobar el desempeño de su actuación en un lapso de tiempo más prolongado. Según el mencionado Plan para la consolidación de los IPT, la implantación del mismo y de la REvalMed contaban con una dotación presupuestaria total en 2021 de 3,5 millones de euros. En todo caso, conviene precisar que los IPT adolecen de la misma falta de definición y desarrollo normativo que es endémica en toda la configuración de la evaluación de la eficiencia de los medicamentos, ya que no se ha definido legalmente qué son los IPT y cómo encajan en el procedimiento de financiación y fijación del precio de los medicamentos, lo que genera problemas de transparencia y control teniendo en cuenta su creciente relevancia en dichos procedimientos.
En cuarto lugar, debe destacarse la creación del Sistema de información para determinar el valor terapéutico en la práctica clínica real de los medicamentos de alto impacto sanitario y económico en el Sistema Nacional de Salud (denominado Valtermed). Este sistema, iniciado en 2019 y coordinado desde la Dirección General de Cartera de Servicios del SNS y Farmacia, trata de integrar datos de carácter administrativo, clínico y terapéutico que permitan conocer el estado inicial y la evolución de los pacientes tras iniciar un tratamiento farmacológico. Aunque su impacto por ahora es limitado32, puede convertirse en una pieza clave en los procesos de evaluación continua, donde debe integrarse también la parte económica. Si Valtermed es una señal del regulador que orienta en la dirección que deben tomar los sistemas de información sanitarios para medir resultados en salud, y no solo de procesos, como ocurre en la actualidad, entonces este sistema, con las necesarias mejoras, puede devenir en una herramienta de cambio altamente atractiva. Sin embargo, si es un hecho aislado, sin relación con el desarrollo de los sistemas de información en el seno del SNS, se convertirá en una iniciativa de interés, pero con un recorrido e impacto limitados.
Más allá de los cuatro hechos comentados, las últimas novedades siguen apuntando a un impulso decidido a la evaluación de la eficiencia en el ámbito de los medicamentos. Así, se ha previsto dotación presupuestaria procedente de fondos europeos según el Plan de Recuperación, Transformación y Resiliencia tanto para evaluación de medicamentos como para la red de agencias. El Componente 18 dedicado a Renovación y ampliación de las capacidades del Sistema Nacional de Salud, apartado C18.I5, incluye un “Plan para la racionalización del consumo de productos farmacéuticos y fomento de la sostenibilidad”, con 10,8 millones de euros, destinados a mejoras en los sistemas de evaluación de medicamentos, tecnologías y prestaciones sanitarias. Menciona expresamente tres elementos: la creación de la Red de Evaluación de Medicamentos en el Sistema Nacional de Salud; la valoración de medicamentos de alto impacto en el Sistema Nacional de Salud; y el refuerzo de las actividades de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del SNS. Adicionalmente, se dotan con 7,1 millones de euros acciones formativas, incluido un “Curso para la evaluación avanzada de medicamentos y tecnologías sanitarias”.
Asimismo, se puede apreciar que continúa el impulso normativo pues, en el momento de finalización de este trabajo, se ha iniciado la elaboración de un Anteproyecto de Ley que modificaría el Texto Refundido por el que se aprueba la Ley de Garantía y Uso Racional de los Medicamentos y Productos Sanitarios (TRLGUR)33. A la espera de que se concrete en el proyecto de ley, resulta destacable que la evaluación económica es mencionada como uno de los objetivos, aunque no es la prioridad principal. En particular, con la modificación del TRLGUR se busca “promover el acceso a tecnologías de calidad que demuestren beneficio clínico adicional frente al estándar de tratamiento, profundizar en las medidas de racionalización del gasto farmacéutico, incentivando el uso de los recursos”.
Por otra parte, la evaluación de la eficiencia está recibiendo también un importante impulso fuera del ámbito de los medicamentos. La Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud, establecida en el año 2012 por el Consejo Interterritorial del SNS y cuyo Consejo rector fue creado en 2013 (Orden SSI/1833/2013, de 2 de octubre), se ha reforzado durante los últimos años. Así, ha visto aumentar de manera significativa su presupuesto para el año 2021 y siguientes34. Ello, unido al propio papel que juegan las AETS españolas dentro de la European Network for Health Technology Assessment (EUnetHTA) y del impulso que la Comisión Europea está propiciando en los marcos de colaboración en esta materia, configura a esta Red como un actor de primer orden en el desarrollo de la evaluación de tecnologías sanitarias, en general, y de la evaluación económica, en particular, como herramientas de utilidad para informar las decisiones de financiación y precio de las tecnologías sanitarias.
En los próximos años, el desarrollo de la evaluación de las tecnologías sanitarias deberá ser más intenso si cabe, tanto a nivel europeo como nacional. El trascendental Reglamento (UE) 2021/2282 del Parlamento Europeo y del Consejo de 15 de diciembre de 2021 sobre evaluación de las tecnologías sanitarias, establece un marco común que se constituirá como punto de referencia imprescindible a nivel interno, a pesar de que los Estados miembros conserven sus competencias por lo que se refiere a las decisiones sobre el uso y la financiación de las nuevas tecnologías sanitarias. El Reglamento (UE) 2021/2282 pretende establecer un marco común omnicomprensivo: se extiende a todas las tecnologías (incluidos los medicamentos), y abarca no solo la dimensión médica sino también las dimensiones económica, social y ética. A partir de su aplicación el 12 de enero de 2025 se pondrá en marcha un Grupo de Coordinación sobre Evaluación de Tecnologías Sanitarias de los Estados miembros y se llevará a cabo una evaluación conjunta de tecnologías sanitarias a través de unas normas y metodologías comunes.
Para concluir la sección podemos señalar que en España se encuentra en la actualidad en tramitación el Proyecto de la Ley por la que se modifican diversas normas para consolidar la equidad, universalidad y cohesión del Sistema Nacional de Salud35 que refuerza institucionalmente el sistema de evaluación de tecnologías sanitarias. En concreto, la disposición adicional única prevé dotar de personalidad jurídica propia a la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del SNS (RedETS), bajo la forma de consorcio, con el fin de potenciar el desarrollo de sus actividades, disponer y gestionar sus propios recursos y competir a nivel internacional y nacional por los fondos necesarios para el desarrollo de sus actividades.
6. CONCLUSIONES Y REFLEXIONES FINALES
La EETS proporciona un marco conceptual que permite comparar los beneficios terapéuticos y sociales y los costes sanitarios y sociales de tratamientos y programas alternativos. La evaluación económica es, pues, un eslabón clave en la cadena de la evaluación de las tecnologías sanitarias, puesto que, sin incorporar la dimensión de la eficiencia, la evaluación queda incompleta. Por tanto, ni la evaluación económica es una “cosa de economistas”, ni es un elemento de naturaleza ajena al resto de la familia de técnicas del campo de la evaluación de actuaciones en salud.
La información que genera la evaluación económica puede servir de ayuda en el momento de tomar una decisión, toda vez que la consideración de la dimensión de eficiencia es fundamental para la solvencia de cualquier sistema sanitario, si bien nadie pretende que sea el único elemento a tener en cuenta en un proceso tan complejo. En modo alguno. El papel de los evaluadores debe ser ayudar a los representantes de los ciudadanos y a los decisores sanitarios para que estén mejor informados, con objeto de que los recursos públicos sean asignados de una manera más transparente y racional. Las decisiones deben apoyarse en criterios técnicos claros y objetivos, y en una sólida metodología científico-técnica, pero los argumentos técnicos no pueden sustituir a las decisiones políticas y profesionales.
A pesar de la evidente utilidad de la EETS, ésta no ha terminado de implantarse de manera sólida y sistemática en España. En este sentido, en ocasiones se ha mencionado que el complejo organigrama sanitario y el reparto competencial puede haber jugado en contra del uso de la evaluación económica en nuestro país. No obstante, cabe argumentar que en otros países europeos donde las competencias están tanto o más descentralizadas que en España ello no ha sido óbice para que la evaluación económica desempeñe un papel relevante para informar en los procesos de establecimiento de prioridades y financiación pública en el campo de la política sanitaria (Zozaya et al., 2022). Asimismo, cabe objetar que una parte de las políticas del medicamento siguen estando fuertemente centralizadas en nuestro país (los procesos de decisión sobre financiación y fijación de precio) y, sin embargo, esta centralización tampoco ha favorecido la aplicación de estas técnicas.
La evolución de la EETS en España se caracteriza por la falta de determinación política para implantar un verdadero sistema que resulte determinante en la incorporación de los avances tecnológicos en nuestro sistema sanitario. Aunque existe un marco constitucional y legal que exige el cumplimiento del principio de eficiencia en la asignación de los recursos del SNS, y a pesar de que se ha introducido en la normativa el requisito de considerar la información generada por las evaluaciones económicas para la financiación de innovaciones tecnológicas resulta difícil determinar la relevancia de la eficiencia en dichas decisiones.
La falta de una concreción legal y de un desarrollo reglamentario de los criterios relacionados con la eficiencia, así como de las funciones de los órganos responsables de valorarla, generan una enorme indeterminación que desactiva las virtudes de la EETS. Los destinatarios de estas decisiones (laboratorios, profesionales sanitarios, pacientes) se encuentran ante un amplio margen de discrecionalidad que genera mucha incertidumbre hasta el punto de desconocer el peso específico de la eficiencia en la decisión de incorporación o no de una nueva tecnología y, en su caso, de fijación de su precio.
Asimismo, resulta sorprendente que la EETS se lleve a cabo por las Administraciones sanitarias de forma separada entre los medicamentos y el resto de tecnologías sanitarias. Es dudoso que respecto de la regulación ésta sea la solución óptima. Esta separación podría tener su racionalidad en el pasado, pero muchas innovaciones que llegan a nuestro sistema ponen de manifiesto que esta separación administrativa cada vez es menos funcional y que la creación de compartimentos estancos es un problema evidente a la hora de aprovechar economías de escala que se diluyen entre organizaciones evaluadoras que cuentan con recursos preciosos, pero limitados, y distintos cometidos. Por tanto, parece claro que las evaluaciones realizadas en ambos campos tendrían que estar interrelacionadas, por lo menos en la práctica, incluso si son desarrolladas por organismos diferentes, dadas las proximidades metodológicas entre ellas y la necesidad de utilizar eficientemente a las estructuras y técnicos capaces de realizarlas.
En este sentido, la calidad de los estudios concretos de evaluación de medicamentos y tecnologías sanitarias aún presentan margen de mejora, si bien la adhesión a guías metodológicas consensuadas puede resultar de gran ayuda en este empeño (Giménez et al., 2020). Su cantidad, sin embargo, ha sido modesta, de modo que la productividad de los órganos encargados de realizarla es limitada, o bien otros cometidos han sido prioritarios en sus actividades. Hay que tener en cuenta que dichos órganos tienen medios limitados, que el funcionamiento en red impone costes de transacción y que los trabajos de evaluación de la eficiencia son minoritarios dentro de sus actividades habituales.
En materia regulatoria, la normativa de la evaluación de las tecnologías sanitarias, exceptuados los medicamentos, es relativamente satisfactoria, por lo menos sus normas de superior rango y en los aspectos procedimentales. Por el contrario, la regulación de la evaluación de los medicamentos merece un juicio más crítico. La calificamos de fragmentada, asistemática, discontinua, parcial e insuficiente. Esta situación requiere una iniciativa ambiciosa para mejorarla y completarla a todos los niveles normativos.
También el desarrollo de estudios concretos de evaluación económica de los medicamentos para apoyar su posicionamiento terapéutico y las decisiones concretas de financiación pública y precios a lo largo del tiempo ha sido muy limitado. En la actualidad, se aprecia una voluntad política positiva para poner remedio a esta situación. Se ha concretado ya en iniciativas concretas de planificación (Estrategia IPT), organización (REvalMED), dotación presupuestaria y formación. Sin embargo, el camino por recorrer es largo y exige acciones de amplio alcance, de la mano de desarrollos legislativos al máximo nivel.
La EETS es una exigencia ineludible en la actualidad para cualquier sistema sanitario desarrollado. Obtener información sobre eficiencia puede no ser sencillo, ya que exige un trabajo organizado, cualificado y riguroso y el esfuerzo por parte de los decisores en interpretar los resultados de estos análisis. Sin embargo, no evaluar tecnologías sanitarias incorporando toda la información disponible supone un coste social de oportunidad difícilmente justificable (Puig-Junoy y Oliva, 2009). De hecho, si el principal objetivo de una agencia evaluadora de medicamentos o tecnologías sanitarias, es elaborar información de interés para guiar una toma de decisiones que favorezca una prestación sanitaria efectiva, segura, eficiente, equitativa y responsable con la sostenibilidad económica del sistema sanitario, la evaluación económica debe estar necesariamente presente en el proceso. La alternativa a introducir elementos claros y objetivos en el diseño y evaluación de las políticas sanitarias es actuar desde la opacidad, con falta de responsabilidad y rendición de cuentas a la ciudadanía (Oliva y Puig-Junoy, 2017), estando expuestos a que grupos de presión y elementos mediáticos marquen las agendas de las políticas de salud (Campillo-Artero, García-Armesto y Bernal-Delgado, 2016).
Otros países han incorporado hace tiempo estas herramientas en sus procesos de toma de decisiones, especialmente en el campo de los medicamentos. El llegar con retraso nos permite aprender de sus errores y adaptar a nuestro medio aquellos procesos que han demostrado ser útiles y adecuados (Oliva, Antoñanzas y Rivero Arias, 2008; Lobo, 2015 y 2016). También nos permite ver que los retos presentes en España son compartidos con otros países vecinos y que no hay un modo único de resolverlos, sino diferentes alternativas que deben enmarcarse en el contexto de las necesidades, los recursos, la cultura, la organización y las normas de cada país (Zozaya et al., 2022). Asimismo, tenemos claros ejemplos de buenas prácticas realizadas en nuestro país desde hace tiempo sobre las que apoyarnos para seguir avanzando (Giménez et al., 2020).
La falta de impacto de la evaluación de la eficiencia en España no se ha debido a la falta de profesionales calificados para realizar estos estudios ni para interpretar la información que aportan estas técnicas. Con los incentivos, coordinación y liderazgo adecuados (Abellán Perpiñán y Martínez Pérez, 2016) el volumen de trabajos realizados y su calidad podrían ser superiores a los actuales. Las barreras de uso y aplicación de la evaluación económica en la toma de decisiones ya han sido identificadas y su persistencia se debe al desinterés mostrado por los decisores de más alto nivel y a la debilidad de aquellos agentes que han entendido su relevancia, pero que no han podido influir en su aplicación real.
Para concluir, el marco legal y la práctica de las Administraciones sanitarias deberían haber normalizado desde hace tiempo el uso sistemático de la evaluación de la eficiencia como herramienta de ayuda para la toma de decisiones en el ámbito sanitario español. No ha sido así, aunque reformas recientes apuntan a un cambio en este sentido. Una ventaja evidente de la evaluación económica es que hace explícita una información incorporable en el proceso de toma de decisiones sobre la asignación de los recursos escasos entre alternativas excluyentes que compiten entre sí. Quizás precisamente estos elementos que aluden a la transparencia y a la rendición de cuentas, y que han favorecido su incorporación en otros países europeos, han jugado en su contra en el nuestro. Es tiempo de cambiar esta situación de manera definitiva. Por ello, no cabe sino insistir en que uno de los mayores retos de nuestro sistema de salud es mejorar sus normas y avanzar hacia una cultura de buen gobierno (Meneu y Ortún, 2011; AES, 2013; Oliva, Peiró y Puig-Junoy, 2013; Repullo y Freire, 2016). En este proceso, un aspecto clave es interiorizar que la evaluación, no ya la económica, sino la evaluación, en sentido amplio, no es meramente una opción o un conjunto de herramientas relativamente útil. Es parte del gran cambio que precisamos para garantizar la solvencia de nuestro sistema de salud y para que éste continúe mejorando el bienestar de nuestra sociedad, tal y como lo ha hecho en las últimas décadas.
Bibliografía
Abásolo, I., Abellán, J. M., Abraira, V. et al. (2020). Por un HISPA-NICE: ahora o nunca. Disponible en: https://drive.google.com/file/d/1Wopclsm5AJ8_WpJo80tpHnbf4BK94YCy/view
Abellán Perpiñán, J. M. y Martínez Pérez, J. E. (2016). Cómo articular la cooperación en red de los recursos sobre conocimiento y evaluación en salud y servicios sanitarios en España. ¿Hacia un HispaNICE? Gaceta Sanitaria, 30(Supl 1), pp. 14-18.
Abellán Perpiñán, J. M., Sánchez Martínez, F. I. y Martínez Pérez, J. E. (2009). La medición de la calidad de los estudios de evaluación económica. Una propuesta de “checklist” para la toma de decisiones. Revista Española de Salud Pública, 83(1), pp. 71-84.
AES-Asociación de Economía de la Salud (2008). Posición de la Asociación de Economía de la Salud en relación a la necesidad de un mayor uso de la evaluación económica en las decisiones que afectan a la financiación pública de las prestaciones y tecnologías en el Sistema Nacional de Salud.
AES-Asociación de Economía de la Salud (2009). Aportaciones al diagnóstico sobre el SNS español para un Pacto por la Sanidad.
AES-Asociación de Economía de la Salud (2013). Sistema Nacional de Salud: Diagnóstico y propuestas de avance. Disponible en: http://www.aes.es/sns-diagnostico-propuestas/
Agencia de Calidad y Evaluación (2007). Incidencia de las medidas adoptadas para la racionalización del gasto farmacéutico. Ministerio de Administraciones Públicas. Madrid.
Antoñanzas, F. y Rovira, J. (coord.) (1993). Propuesta de estandarización de algunos aspectos metodológicos de los análisis coste-efectividad y coste-utilidad en la evaluación de tecnologías y programas sanitarios. Estudio financiado por la Dirección General de Prestaciones y Evaluación de Tecnologías Sanitarias, Dirección General de Aseguramiento y Planificación Sanitaria, Ministerio de Sanidad y Consumo.
Antoñanzas, F., Oliva, J., Pinillos, M. y Juárez, C. (2007). Economic Aspects of the New Spanish Law for Pharmaceuticals. European Journal of Health Economics, 8(3), pp. 297-300.
Appleby, J. (2013). Spending on health and social care over the next 50 years. The King’s Fund.
Autoridad Independiente de Responsabilidad Fiscal (2018). Medicamentos dispensados a través de receta médica. Disponible en: https://www.airef.es/wp-content/uploads/2022/04/ESTUDIOS-FIRMADOS/2019-07-02-RECETAS.pdf
Autoridad Independiente de Responsabilidad Fiscal (2019). Gasto hospitalario del Sistema Nacional de Salud: Farmacia e inversión en bienes de equipo. Disponible en: https://www.airef.es/wp-content/uploads/2020/10/SANIDAD/PDF-WEB-Gasto-hospitalario-del-SNS.pdf
Bernal, E., Campillo, C., González, B., Meneu, R., Puig-Junoy, J., Repullo, J. R. y Urbanos, R. (2011). La sanidad pública ante la crisis. Recomendaciones para una actuación pública sensata y responsable. Asociación de Economía de la Salud.
Cabiedes, L. (2012). Evaluación económica de medicamentos en España: mucho ruido y pocas nueces. Economía y salud: boletín informativo, 75, pp. 1-5.
Cabiedes, L. (2013). Nuevas perspectivas sobre el precio de los medicamentos: El caso español. Estudios de economía aplicada, 31(2), pp. 397-416.
Campillo-Artero, C., Garcia-Armesto, S. y Bernal-Delgado, E. (2016). The merry-go-round of approval, pricing and reimbursement of drugs against the Hepatitis C virus infection in Spain. Health Policy, 120(9), pp. 975-981.
Catalá-López, F. y García-Altés, A. (2010). Evaluación económica de intervenciones sanitarias en España durante el periodo 1983-2008. Revista Española de Salud Pública, 84(4), pp. 353-369.
Catalá-López, F., Ridao, M., Alonso-Arroyo, A., García-Altés, A., Cameron, C., González-Bermejo, D., Aleixandre-Benavent, R., Bernal-Delgado, E., Peiró, S., Tabarés-Seisdedos, R. y Hutton, B. (2016). The quality of reporting methods and results of cost-effectiveness analyses in Spain: A methodological systematic review. Systematic Reviews, 5, p. 6.
Catalá-López, F. y Ridao, M. (2016). Mejorar la transparencia y la credibilidad de los análisis coste-efectividad de las intervenciones sanitarias. Revista Española de Salud Pública, Vol. 90, pp. e1-e4.
Catalá-López, F. y Ridao, M. (2017). Potencial sesgo de patrocinio en los análisis coste-efectividad de intervenciones sanitarias: un análisis transversal. Atención Primaria, 49(6), pp. 335-342.
Comisión Nacional de los Mercados y la Competencia (2015a). IPN/CNMC/005/15 Informe sobre el proyecto de Real Decreto legislativo por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. 12 de marzo de 2015. Disponible en: https://www.cnmc.es/sites/default/files/588085_11.pdf
Comisión Nacional de los Mercados y la Competencia (2015b). IPN/CNMC/023/15 Proyecto de Real Decreto por el que se regula la financiación y fijación de precios de medicamentos y productos sanitarios y su inclusión en la prestación farmacéutica del Sistema Nacional de Salud. 19 de noviembre de 2015. Disponible en: https://www.cnmc.es/sites/default/files/757377_11.pdf
Comisión Nacional de los Mercados y la Competencia (2022). Estudio sobre el mercado de distribución mayorista de medicamentos E/CNMC/002/17. Disponible en: https://www.cnmc.es/expedientes/ecnmc00217
Consejo Interterritorial del Sistema Nacional de Salud (2010). Acciones y medidas para promover la calidad, la equidad, la cohesión y la sostenibilidad del Sistema Nacional de Salud. Madrid, 18 de marzo. Disponible en: https://www.lamoncloa.gob.es/documents/9475-D6BC-18032010documentoconsejointerterritorialpactoporla.pdf
Drummond, M. (2002). Twenty Years of Using Economic Evaluations for Reimbursement Decisions. What Have We Achieved? CHE Research Paper, 75. Centre for Health Economics, University of York, UK.
Epstein, D. y Espín, J. (2020). Evaluation of new medicines in Spain and comparison with other European countries. Gaceta Sanitaria, 34, pp. 133-140.
Espín Balbino, J., Brosa Riestra, M., Oliva, J., Trapero-Bertran, M. y Key4Value-Grupo III (2015). Cuestiones controvertidas en evaluación económica (III): la evaluación económica de intervenciones sanitarias en tres situaciones especiales: enfermedades raras, los tratamientos al final de la vida y las externalidades en las evaluaciones. Revista Española de Salud Pública, 89(3), pp. 237-247.
European Comission (varios años). Ageing Report: Economic and Budgetary Projections for the EU Member States.
Federación Española de Empresas de Tecnología Sanitaria (FENIN). Memoria Anual de Sostenibilidad 2022 de Fenin. Disponible en: https://www.phmk.es/tag/memoria-anual-de-sostenibilidad-2022-de-fenin
Giménez, E., García-Pérez, L., Márquez, S., Gutiérrez, M. A., Bayón, J. C. y Espallargues, M. (2020). Once años de evaluaciones económicas de productos sanitarios en la Red de Agencias de Evaluación. Calidad metodológica e impacto del coste-utilidad. Gaceta Sanitaria, 34(4), pp. 326-333.
González López-Valcarcel, B. (2022). Evaluación de políticas. Salud y Sanidad. Papeles de Economía Española, 172. Monográfico “Evaluación de Políticas Públicas”, pp. 110-125.
Greer, S. L., Vasev, N., Jarman, H., Wismar, M. y Figueras, J. (2019). It’s the governance, stupid! TAPIC: A governance framework to strengthen decision making and implementation [Internet]. Copenhagen (Denmark): European Observatory on Health Systems and Policies.
Habermas, J. (1999). Tres modelos de democracia. Sobre el concepto de una política deliberativa. En La inclusión del otro, Barcelona: Paidós, pp. 231-246.
Hoffmann, C. y Graf von der Schulenburg, J. M. (2000). The influence of economic evaluation studies on decision making. A European survey. The EUROMET group. Health Policy, 52(3), pp. 179-192.
Jöhnson, B. (2011). Relative effectiveness and the European pharmaceutical market. European Journal of Health Economics, 12(2), pp. 97-102.
Lobo, F. (2013). La intervención de precios de los medicamentos en España. Panorama de la regulación y los estudios empíricos. Springer Healthcare. Madrid. 159 p. http://e-archivo.uc3m.es/bitstream/handle/10016/21688
Lobo, F. (2015). Políticas actuales de precios de medicamentos en Europa: panorama general. Springer Healthcare. Madrid. http://e-archivo.uc3m.es/bitstream/handle/10016/23136
Lobo, F. (2016). Análisis y práctica de las políticas de precios y financiación de medicamentos. Springer Healthcare. Madrid. https://e-archivo.uc3m.es/handle/10016/26086
Lobo, F. (2017). La Economía, la innovación y el futuro del Sistema Nacional de Salud. Funcas. Madrid. https://www.funcas.es/wp-content/uploads/Migracion/Publicaciones/PDF/2078.pdf
López-Bastida, J. y Oliva, J. (coord.) (2008). Instrumento para la Evaluación de la Calidad de los Análisis Económicos en Evaluación de TS en Elaboración y validación instrumentos metodológicos para la evaluación de productos de las Agencias de Evaluación de Tecnologías Sanitarias. Madrid: Plan de Calidad para el SNS del MSC. Ministerio de Sanidad y Consumo y Agencia Laín Entralgo. Madrid. ISBN: 978-84-451-3150-3.
López-Bastida, J., Oliva, J., Antoñanzas, F., García, A., Gisbert, A., Mar, J. y Puig-Junoy, J. (2010). Propuesta de guía para la evaluación económica aplicada a las tecnologías sanitarias. Gaceta Sanitaria, 24(2), pp. 154-170.
Meneu, R. y Ortún, V. (2011). Transparencia y buen gobierno en sanidad. También para salir de la crisis. Gaceta Sanitaria, 25(4), pp. 333-338.
Ministerio de Sanidad y Consumo (2004). Plan Estratégico de Política Farmacéutica para el Sistema Nacional de Salud Español. Madrid.
Ministerio de Sanidad (2020). Plan para la consolidación de los informes de posicionamiento terapéutico de los medicamentos en el Sistema Nacional de Salud. 8 de julio. Disponible en: https://www.sanidad.gob.es/en/profesionales/farmacia/IPT/docs/20200708.Plan_de_accion_para_la_consolidacion_de_los_IPT.actCPF8Julio.pdf
Ministerio de Sanidad (2022). Documento informativo sobre la financiación y fijación del precio de los medicamentos en España. Disponible en: https://www.sanidad.gob.es/profesionales/farmacia/pdf/20220526_Doc_Infor_Financiacion_Med_Esp.pdf
Oliva, J., Antoñanzas, F. y Rivero-Arias, O. (2008). Evaluación económica y la toma de decisiones en salud. El papel de la evaluación económica en la adopción y difusión de tecnologías sanitarias. Informe SESPAS 2008. Gaceta Sanitaria, 22 (Suppl 1), pp. 137-142.
Oliva, J., Brosa, M., Espín, J., Figueras, M., Trapero, M. y Key4Value-Grupo I (2015). Cuestiones controvertidas en evaluación económica (I): perspectiva y costes de intervenciones sanitarias. Revista Española de Salud Pública, 89(1), pp. 5-14.
Oliva, J., del Llano, J., Antoñanzas, F., Juárez, C., Rovira, J. y Figueras, M. (2000). Impacto de los estudios de evaluación económica en la toma de decisiones sanitarias en el ámbito hospitalario. Gestión Hospitalaria, 11(4), pp. 171-179.
Oliva, J., del Llano, J., Antoñanzas, F., Juárez, C., Rovira, J., Figueras, M. y Gervás, J. (2001). Impacto de los estudios de evaluación económica en la toma de decisiones sanitarias en Atención Primaria. Cuadernos de Gestión, 7, pp. 192-202.
Oliva, J., del Llano, J. y Sacristán, J. A. (2002). Análisis de las evaluaciones económicas de tecnologías sanitarias realizadas en España en la década 1990-2000. Gaceta Sanitaria, 16(4), pp. 334-343.
Oliva, J., Peiró, S. y Puig-Junoy, J. (2013). Horizontes de cambio en el Sistema Nacional de Salud: agenda para una reforma sanitaria ordenada. Economistas, 136, pp. 6-14.
Oliva, J. y Puig-Junoy, J. (2017). Evaluación económica de medicamentos en España: El traje del emperador. Disponible en: http://nadaesgratis.es/sergi-jimenez/evaluacion-economica-de-medicamentos-en-espana-el-traje-del-emperador; http://pilleconomics.blogspot.com.es/2017/02/evaluacion-economica-de-medicamentos-en.html
Oliva Moreno, J., Worbes Cerezo, M., López Bastida, J. y Serrano Aguilar, P. (2009). Impacto de la evaluación económica de tecnologías sanitarias en las decisiones sanitarias: Encuesta a Decisores. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social. Servicio de Evaluación del Servicio Canario de la Salud; 2010. Informes de Evaluación de Tecnologías Sanitarias, SESCS Nº 2007/03. Disponible en: http://funcanis.es/impacto-de-la-evaluacion-economica-de-tecnologias-sanitarias-en-las-decisiones-sanitarias/
Organización Médica Colegial (OMC) (2004). Informe sobre el Sector Farmacéutico. Disponible en: https://www.cgcom.es/sites/default/files/informe_omc_sector_farmaceutico_oct_2014.pdf
Organization for Economic Cooperation and Development (OECD) (2011). Health at a Glance 2011. OECD Indicators. OECD Publishing. Paris. Disponible en: www.oecd.org/els/health-systems/49105858.pdf
O’Rourke, B., Oortwijn, W. y Schuller, T. (2020). The new definition of health technology assessment: A milestone in international collaboration. Int J Technol Assess Health Care, 1–4.
Ortega Eslava, A., Marín Gil, R., Fraga Fuentes, M. D., López-Briz, E. y Puigventós Latorre, F. (GENESIS-SEFH) (2017). Guía de evaluación económica e impacto presupuestario en los informes de evaluación de medicamentos. SEFH. Sociedad Española de Farmacia Hospitalaria.
Paris, V. y Belloni, A. (2013). Value in pharmaceutical pricing (2013). OECD Health Working Papers, No. 63, OECD. Disponible en: https://www.oecd-ilibrary.org/social-issues-migration-health/value-in-pharmaceutical-pricing_5k43jc9v6knx-en
Puig-Junoy, J. y Oliva, J. (2009). Evaluación económica de intervenciones sanitarias: el coste de oportunidad de no evaluar. Reumatología Clínica, 5(6), pp. 241-243.
Puig-Junoy, J., Oliva-Moreno, J., Trapero-Bertrán, M., Abellán-Perpiñán, J. M., Brosa-Riestra, M. y Servei Català de la Salut (CatSalut) (2014). Guía y recomendaciones para la realización y presentación de evaluaciones económicas y análisis de impacto presupuestario de medicamentos en el ámbito del CatSalut. Barcelona: Generalitat de Catalunya. Departament de
Salut. Servei Català de la Salut. Disponible en: https://catsalut.gencat.cat/web/.content/minisite/catsalut/proveidors_professionals/medicaments_farmacia/farmaeconomica/caeip/gaeip_publica_castellano_octubre2014_catsalut.pdf
Repullo, J. R. y Freire, J. M. (2016). Implementando estrategias para mejorar el gobierno institucional del Sistema Nacional de Salud. Gaceta Sanitaria, 30 (Supl 1), pp. 3-8.
Ridao, M. y Catalá-López, F. (2016). La calidad en la presentación de métodos y resultados de los análisis de coste-efectividad de intervenciones cardiovasculares. Rev Esp Cardiol, 69, pp. 876-877.
Sacristán, J. A., Oliva, J., Campillo-Artero, C., Puig-Junoy, J. et al. (2020). ¿Qué es una intervención sanitaria eficiente en España en 2020? Gaceta Sanitaria, 34(2), pp. 189-193.
Sanz-Granda, A., Hidalgo, A., del Llano, J. E. y Rovira, J. (2013). Analysis of economic evaluations of pharmacological cancer treatments in Spain between 1990 and 2010. Clinical and Translational Oncology, 15(1), pp. 9–19.
Segú-Tolsa, J. L., Puig-Junoy, J. y Espinosá-Tomé, C. (coord.) (2014). Guía para la definición de criterios de aplicación de esquemas de pago basados en resultados (EPR) en el ámbito farmacoterapéutico. Servei Català de la Salut.
Servicio Canario de la Salud (2004). Plan de Salud de Canarias 2004-2008. Más salud y mejores servicios. Santa Cruz de Tenerife: Consejería de Sanidad del Gobierno de Canarias. Disponible en: https://www3.gobiernodecanarias.org/sanidad/scs/scs/1/plansalud/plansalud2004_2008/BLOQUE3_PLAN_Y_OBJETIVOS.pdf
Sociedad Española de Salud Pública y Administración Sanitaria (SESPAS) (2017). Posicionamiento SESPAS sobre inclusión de medicamentos en la financiación pública del Sistema Nacional de Salud y fijación de precios. http://sespas.es/2017/02/23/posicionamiento-sespas-sobre-inclusion-de-medicamentos-en-la-financiacion-publica-del-sistema-nacional-de-salud-y-fijacion-de-precios/
Trapero-Bertran, M., Brosa Riestra, M., Espín Balbino, J., Oliva, J. y Key4Value-Grupo II (2015). Cuestiones controvertidas en evaluación económica (II): medidas de resultado en salud de las intervenciones sanitarias. Revista Española de Salud Pública, 89(2), pp. 125-135.
Tribunal de Cuentas. Informe de fiscalización de la actividad económica desarrollada por el Ministerio de Sanidad, Servicios Sociales e Igualdad en relación con el área farmacéutica, ejercicios 2014 y 2015. Disponible en: http://www.tcu.es/tribunal-de-cuentas/es/sala-de-prensa/news/APROBADO-EL-INFORME-DE-LA-ACTIVIDAD-ECONOMICA-DEL-MINISTERIO-DE-SANIDAD-SERVICIOS-SOCIALES-E-IGUALDAD-EN-EL-AREA-FARMACEUTICA-2014-Y-2015/
Vallejo-Torres, L., García-Lorenzo, B., Castilla, I., Valcárcel Nazco, C., García Pérez, L., Linertová, R. y Serrano-Aguilar, P. (2015). Valor Monetario de un Año de Vida Ajustado por Calidad: Estimación empírica del coste de oportunidad en el Sistema Nacional de Salud. Ministerio de Sanidad, Servicios Sociales e Igualdad. Servicio de Evaluación del Servicio Canario de la Salud. Informes de Evaluación de Tecnologías Sanitarias. Disponible en: http://funcanis.es/valor-monetario-de-un-avac-estimacion-empirica-del-coste-de-oportunidad-en-el-sns/
Vallejo-Torres, L., García-Lorenzo, B., García-Pérez, L., Castilla, I., Valcárcel Nazco, C., Linertová, R., Cuéllar Pompa, L. y Serrano-Aguilar, P. (2014). Valor Monetario de un Año de Vida Ajustado por Calidad: Revisión y Valoración Crítica de la Literatura. Ministerio de Sanidad, Servicios Sociales e Igualdad. Servicio de Evaluación del Servicio Canario de la Salud. Informes de Evaluación de Tecnologías Sanitarias. Disponible en: http://funcanis.es/valor-monetario-de-un-ano-de-vida-ajustado-por-calidad-revision-y-valoracion-critica-de-la-literatura/
Vallejo-Torres, L., García-Lorenzo, B., Rivero-Arias, O., Pinto-Prades, J. L. y Serrano-Aguilar, P. (2016). Disposición a pagar de la sociedad española por un Año de Vida Ajustado por Calidad. Ministerio de Sanidad, Servicios Sociales e Igualdad. Servicio de Evaluación del Servicio Canario de la Salud. Informes de Evaluación de Tecnologías Sanitarias. Disponible en: https://funcanis.es/wp-content/uploads/2015/09/SESCS_2016_DAP_AVAC.pdf
Varela-Lema, L., Atienza-Merino, G. y López-García, M. (2017). Priorización de intervenciones sanitarias. Revisión de criterios, enfoques y rol de las agencias de evaluación. Gaceta Sanitaria, 31, pp. 349–357.
Vida Fernández, J. (2004). Las prestaciones sanitarias del Sistema Nacional de Salud: catálogo de prestaciones y carteras de servicios. En: L. Parejo, M. Vaquer y A. Palomar (coords.), La reforma del Sistema Nacional de Salud: cohesión, calidad y estatutos profesionales. Marcial Pons, págs. 37-110.
Vida Fernández, J. (2011). Sostenibilidad y sistema sanitario: Crisis económica, prestaciones sanitarias y medidas de ahorro. Derecho y Salud, vol. 21, núm. 2, pp. 13-34.
Vida Fernández, J. (2017). Financiación pública y fijación del precio de los medicamentos. En: J. Faus y J. Vida (dirs.), Tratado de Derecho Farmacéutico. Thomson Reuters-Aranzadi, pp. 931-1040.
Zozaya, N., Villaseca, J., Abdalla, F., Fernández, I. e Hidalgo-Vega, A. (2022). El proceso de evaluación y financiación de los medicamentos en España: ¿dónde estamos y hacia dónde vamos? Madrid: España. Fundación Weber. Disponible en: https://weber.org.es/publicacion/el-proceso-de-evaluacion-y-financiacion-de-los-medicamentos-en-espana-donde-estamos-y-hacia-donde-vamos/
Notas
* Catedrático emérito, Dpto. de Economía, Universidad Carlos III de Madrid.
** Catedrático de Economía, Universidad de Castilla-La Mancha.
*** Profesor titular de Derecho Administrativo, Universidad Carlos III de Madrid.
1 Art. 3 l. Directiva 2011/24/UE del Parlamento Europeo y del Consejo, de 9 de marzo de 2011, relativa a la aplicación de los derechos de los pacientes en la asistencia sanitaria transfronteriza.
2 Considerando 1 del Reglamento (UE) 2021/2282 del Parlamento Europeo y del Consejo de 15 de diciembre de 2021 sobre evaluación de las tecnologías sanitarias y por el que se modifica la Directiva 2011/24/UE.
3 Considerando 2 del Reglamento (UE) 2021/2282.
4 Artículo 2.5 del Reglamento (UE) 2021/2282.
5 Véase, por ejemplo, Vallejo-Torres, L. et al. (2014) y Sacristán, J. A. et al. (2020).
6 “El progreso de las tecnologías médicas continúa transformando la asistencia sanitaria y mejorando la esperanza y la calidad de vida, pero también es uno de los principales motores del crecimiento del gasto sanitario en los distintos países de la OCDE” (OECD, 2011).
7 La Agencia de Evaluación de Tecnologías Sanitarias, principal referente nacional en la materia, se crea dentro del Instituto de Salud Carlos III (ISCIII) en el año 1994. Incluso anteriores en el tiempo son OSTEBA, el Servicio de Evaluación de Tecnologías Sanitarias del País Vasco, y la Agencia de Evaluación de Tecnología e Investigación Médicas de Cataluña. Posteriormente se crearon la Agencia de Evaluación de Tecnologías Sanitarias de Andalucía, el Servicio de Evaluación y Planificación del Servicio Canario de la Salud, el Instituto Aragonés de Ciencias de la Salud, AVALIA-T en Galicia y la Unidad de Evaluación de Tecnologías Sanitarias de la Comunidad de Madrid.
8 Fue derogado por la Ley 14/2007, de 3 de julio, de Investigación biomédica, pero entonces para la evaluación de las tecnologías sanitarias ya se contaba con la base legal alternativa de la Ley de Cohesión y Calidad del SNS de 2003.
9 Desde 1958 era obligatorio para el Estado financiar con fondos públicos todos los medicamentos comercializados (principio plasmado en la Ley General de Seguridad Social de 1963 y en convenios con industria, mayoristas y farmacéuticos). A partir de 1978 se aprecia la preocupación por la creciente expansión de la prestación farmacéutica que se refleja en el Real Decreto 946/1978, por el que se regula el procedimiento de evaluación y control de la prestación farmacéutica de la Seguridad Social. Se trata de la primera norma donde se reflejan los principios de lo que sería la racionalización del uso de los medicamentos, ya que se excluyen los medicamentos publicitarios (art. 7) y se disponía que la adquisición y selección de los medicamentos se realizará conforme a rigurosos criterios científicos y económicos, siendo de preferente consideración, entre otros, los medicamentos de menor costo (art. 11).
10 Disposición adicional quinta LGS. “En el Sistema Nacional de Salud, a los efectos previstos en el artículo 10, apartado 14, y en el artículo 18.4, se financiarán con fondos públicos los nuevos medicamentos y productos sanitarios más eficaces o menos costosos que los ya disponibles. Podrán excluirse, en todo o en parte, de la financiación pública, o someterse a condiciones especiales, los medicamentos y productos sanitarios ya disponibles, cuyas indicaciones sean sintomatológicas, cuya eficacia no esté probada o los indicados para afecciones siempre que haya para ellos una alternativa terapéutica mejor o igual y menos costosa”.
El alcance de la eficiencia en la financiación selectiva fue limitado y se manifestó en la desfinanciación de medicamentos por el Real Decreto 83/1993 y el Real Decreto 1663/1998, que excluyeron de la financiación pública medicamentos con un valor terapéutico reducido. Con el Real Decreto Ley 16/2012 se puso en marcha una nueva lista negativa, como una medida más de lucha contra el déficit por la crisis económica, también limitada. La aplicación del criterio de eficiencia en la financiación selectiva respecto de productos de nueva comercialización únicamente cobra relevancia en tiempos recientes.
11 La financiación selectiva prevista en el artículo 94 LM se basaba en unos criterios de carácter sanitario (gravedad, duración y secuelas de las distintas patologías; utilidad terapéutica), social (necesidades de ciertos colectivos; utilidad social), económico (existencia de medicamentos ya disponibles y otras alternativas mejores o iguales para las mismas afecciones a menor precio o inferior costo de tratamiento) y presupuestario (limitación del gasto público destinado a prestación farmacéutica).
12 En cambio, la LCCSNS de 2003 no introdujo ningún cambio relevante en materia de evaluación de la eficiencia de los medicamentos, remitiendo a la Ley 25/1990 (art. 16). Esta separación entre tecnologías sanitarias y medicamentos se ha mantenido en toda la legislación y organización posterior. En efecto, para los medicamentos prevé un régimen especial pues dispone que la AEMPS asume “…la realización de los análisis económicos necesarios para la evaluación de estos productos…” (art. 31). El Real Decreto 1030/2006, por el que se establece la cartera de servicios comunes del SNS y la Orden SCO/3422/2007, por la que se desarrolla el procedimiento de actualización de la cartera de servicios comunes, mantienen este régimen especial para los medicamentos: “no se aplicará el régimen de actualización (de la cartera de servicios) previsto en esta norma a la prestación farmacéutica que se regirá por su propia normativa…”. (art. 7.4 Real Decreto 1030/2006).
13 Véase el sitio web de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud: https://redets.sanidad.gob.es/conocenos/queHacemos/home.htm
14 Entre las funciones que asumen las agencias y unidades de esta RedETS se encuentran las siguientes (González López-Valcárcel, 2022): informes de evaluación de tecnologías sanitarias, Informes de evaluación de medicamentos (estudios coste-efectividad), guías de práctica clínica, proyectos de investigación (convocatorias competitivas nacionales e internacionales), compra pública innovadora, radar de detección de tecnologías emergentes a evaluar, guía de desinversión (detección de tecnologías obsoletas o que no aportan valor), metodología de la evaluación, y formación y transferencia de conocimiento.
15 De libre acceso en: https://redets.sanidad.gob.es/productos/buscarProductos.do?metodo=buscaTipos&tipoId=1
16 Si se tienen en cuenta únicamente los informes de evaluación de tecnologías sanitarias, de los cuales solo una parte incluyen evaluaciones económicas, entre 1995 y 2022 el conjunto de miembros de la RedETS había publicado 669 informes, es decir unos 26 informes por año. La actividad evaluadora se ha acelerado en la última década (González López-Valcárcel, 2022).
17 Su artículo 89 decía que “La inclusión de medicamentos en la financiación del Sistema Nacional de Salud se posibilita mediante la financiación selectiva y no indiscriminada…” y mencionaba los mismos criterios de 1990 (más el grado de innovación del medicamento). Solamente hay una aproximación expresa en el artículo 89.3 LGURM: “La decisión de excluir total o parcialmente o someter a condiciones especiales de financiación los medicamentos ya incluidos en la prestación farmacéutica del Sistema Nacional de Salud, se hará… teniendo en cuenta el precio o el coste del tratamiento de los medicamentos comparables existentes en el mercado…”. Este criterio del menor precio o el coste de los comparables no se contemplaba, sin embargo, entre los criterios para la financiación ex novo de medicamentos, cuando, sorprendentemente, había figurado como criterio en la LM 1990.
18 Hay que recordar que el RDL tiene el máximo rango normativo, ley formal, y que es un instrumento legislativo de carácter excepcional y urgente. Ello da idea de la importancia y de la perentoriedad de las medidas adoptadas. Como es lógico, la utilización de los RDL, sobre todo si es reiterada, choca con el ideal de regulación estable (Lobo, 2013).
19 Las modificaciones efectuadas en la LGURM 2006, se incorporaron en su texto refundido de 2015 (Real Decreto Legislativo 1/2015, de 24 de julio). El Título VIII trata “De la financiación pública de los medicamentos y productos sanitarios” y sus artículos 92 (Procedimiento para la financiación pública), 94 (Fijación de precios) y 95 (Del Comité Asesor para la Financiación de la Prestación Farmacéutica del Sistema Nacional de Salud) son los directamente relacionados con este estudio.
20 El RDL 9/2011 en el mismo precepto lo organizaba diciendo que “Dicho Comité, presidido por la Dirección General de Farmacia y Productos Sanitarios del Ministerio de Sanidad, Política Social e Igualdad, estará integrado por expertos designados por el Consejo Interterritorial del Sistema Nacional de Salud, a propuesta de las Comunidades Autónomas, de las Mutualidades de funcionarios y del Ministerio. Las reglas de organización y funcionamiento del citado Comité serán establecidas por el Consejo Interterritorial del Sistema Nacional de Salud”.
21 Este Comité, heredero del non natus previsto por el RDL 9/2011 fue una de las modificaciones que se introdujeron en el RDL 16/2012 por vía de corrección de errores. Se le atribuye carácter científico-técnico y es “encargado de proporcionar asesoramiento, evaluación y consulta sobre la pertinencia, mejora y seguimiento de la evaluación económica necesaria para sustentar las decisiones de la Comisión Interministerial de Precios de los Medicamentos” (artículo 90 bis). Deberá estar integrado por siete miembros, profesionales de reconocido prestigio, con experiencia y trayectoria acreditadas en evaluación fármaco-económica.
22 Se trata de la Agencia de Calidad y Evaluación Sanitarias de Cataluña (AQuAS); Servicio de Evaluación de Tecnologías Sanitarias-Osteba, Gobierno Vasco; Agencia Gallega de Gestión del Conocimiento en Salud (Avalia-t, ACIS); Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (AETSA); Instituto Aragonés de Ciencias de la Salud (IACS); Servicio de Evaluación y Planificación del Servicio Canario de Salud (SESCS); Unidad de Evaluación de Tecnologías Sanitarias (UETS) de la Comunidad de Madrid y la Agencia de Evaluación de Tecnologías Sanitarias (AETS) del Instituto de Salud Carlos III.
23 De libre acceso en: https://redets.sanidad.gob.es/productos/buscarProductos.do?metodo=buscaTipos&tipoId=1 (último acceso el 1 de julio de 2022).
24 En cuanto órgano permanente de coordinación, cooperación, comunicación e información de los servicios de salud entre ellos y con la Administración del Estado (art. 69 LCCSNS), que es el competente para acordar la actualización de cartera de servicios que se lleva a cabo mediante orden del titular del Ministerio de Sanidad (art. 21 LCCSNS).
25 Cabe señalar que Canarias cuenta con una de las AETS más destacadas en España por su excelente trabajo, sostenido en el tiempo, en materia de evaluación de la eficiencia de tecnologías sanitarias: el Servicio de Evaluación y Planificación del Servicio Canario de la Salud, perteneciente a la Dirección del Servicio Canario de la Salud. Su equipo “está constituido por un grupo multidisciplinar de investigadores (economistas, epidemiólogos, psicólogos, sociólogos, antropólogos, estadísticos, evaluadores de servicios sanitarios)”. Sus trabajos son de libre acceso en: https://www3.gobiernodecanarias.org/sanidad/scs/organica.jsp?idCarpeta=993a9b1d-7aed-11e4-a62a-758e414b4260 (último acceso el 1 de julio de 2022).
26 Como ejemplo de ello, y de la insatisfacción generada con esta situación, en diciembre de 2020 se publicó un manifiesto, firmado por más de 300 profesionales, significativamente titulado “Por un HISPA-NICE: ahora o nunca” (Abásolo et al., 2020) que motivó una Proposición no de Ley para su creación que resultó finalmente rechazada (PNL presentada por el Grupo Parlamentario Plural que fue rechazada en la Comisión de Sanidad y Consumo de 25 de noviembre de 2021).
27 Orden de nombramiento del Comité Asesor para la Financiación de la Prestación Farmacéutica del SNS. 1 de abril de 2019. Ministerio de Sanidad.
28 Los documentos mencionados y la propuesta de líneas estratégicas de trabajo de este comité pueden ser consultados en: https://www.sanidad.gob.es/profesionales/farmacia/Comite_Asesor_PFSNS.htm
29 REvalMED se encuentra conformado por siete nodos de evaluación en los que se integran expertos designados por las CC. AA. (para más detalles, vid. Ministerio de Sanidad, 2022).
30 De libre acceso en: https://www.sanidad.gob.es/profesionales/farmacia/IPT/home.htm
31 “Es asimismo necesario un desarrollo ulterior de los distintos aspectos incluidos en el Plan para la consolidación de los informes de posicionamiento terapéutico en relación con la evaluación económica, con el fin de aclarar la metodología que se utilizará y añadir transparencia al proceso de evaluación económica, así como explicar cómo se realizará la evaluación económica cuando no haya evidencia disponible suficiente, o no existan comparadores válidas” (CNMC, 2022).
32 A finales de 2021 se habían elaborado trece protocolos fármaco-clínicos que podrían afectar a 11.000 pacientes (González López-Valcárcel, 2022).
33 La consulta pública del anteproyecto de ley por la que se modifica el Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios estuvo abierta desde el 6 de julio al 31 de julio de 2022.
34 Un incremento del 48 % para el desarrollo del plan anual de trabajo de 2022. Plan Estratégico RedETS. Accesible en: https://redets.sanidad.gob.es/Consulta_publica/Documentos/Plan_Estrategico_RedETS_2022_2025.pdf
35 Presentado al Congreso de los Diputados el 26 de junio de 2022.
