Las dinámicas de contagio en las ciudades
Fecha: febrero 2021
Usama Bilal*
Ciudades, Dinámica de contagios, Desigualdad social, COVID-19, Salud urbana
Panorama Social, N.º 32 (diciembre 2020)
La vida en las ciudades está marcada por una multitud de características y dinámicas específicas, entre ellas, las que afectan a la transmisión de infecciones. Ahora bien, los procesos de contagio de enfermedades en las ciudades no se prestan a explicaciones universales y sencillas, toda vez que dependen de la naturaleza de cada enfermedad y también de los contextos locales particulares. La pandemia provocada por el COVID-19 ha puesto de manifiesto la existencia de importantes desigualdades sociales dentro de las ciudades. Estas desigualdades quedan reflejadas, particularmente, en la salud. El combate contra el coronavirus también requiere tener en cuenta cómo están construidas las ciudades y de qué forma, dentro de ellas, se distribuye la población según su riesgo de infección.
1. Introducción
La enfermedad por coronavirus, o COVID-19, ha cambiado el mundo, y especialmente nuestras ciudades. A 1 de agosto de 2020, se habían confirmado aproximadamente 680.000 muertes en el mundo, cerca de 18 millones de contagiados, aunque estos números representan probablemente una enorme infraestimación (Dong, Du y Gardner, 2020). Según el estudio ENE-COVID, realizado por el Centro Nacional de Epidemiologia y único en el mundo hasta el momento, alrededor del 5 por ciento de la población de España ha estado expuesta al virus, llegando esta proporción al 11-14 por ciento en lugares como Madrid y las provincias circundantes (Pollán et al., 2020). El exceso estimado de muertes (respecto a la mortalidad habitual en España), a 1 de agosto de 2020, se cifra en torno a 45.000 (Instituto Nacional de Estadistica, 2020). Esto supone, en el caso de Madrid y Barcelona, un aumento del 432 por ciento y del 286 por ciento respecto a años previos (Sevillano, 2020). En los peores momentos de la pandemia, la esperanza de vida cayo hasta 11 años en Madrid y Castilla-La Mancha (Trias-Llimos, Riffe y Bilal, 2020).
Mucho se ha hablado del papel de las ciudades en esta pandemia. En este artículo quiero repasar la importancia de las ciudades en la salud de las poblaciones, resumir investigaciones clásicas en salud urbana de los últimos siglos, trazar una serie de conceptos básicos sobre el contagio en zonas urbanas utilizando el sarampión y la gripe como ejemplos, y orientar a los lectores sobre cómo entender las consecuencias del nuevo coronavirus en zonas urbanas entre quienes se exponen al virus y quienes son más vulnerables a él, con la consiguiente emergencia de desigualdades en salud. Aunque pueda parecer que el COVID-19 es una cuestión de virus y pruebas, nuestra capacidad para controlarlo y mitigar sus impactos está muy determinada por la manera en la que construimos ciudades y la prevalencia de enfermedades crónicas en la población.
2. La importancia de las ciudades en la salud
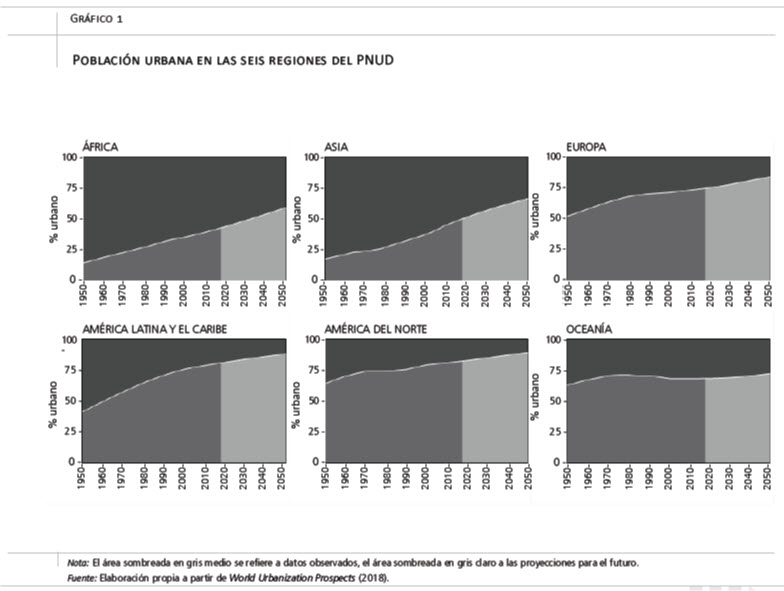
Nuestro planeta gira alrededor de las ciudades. Más de la mitad de toda la población mundial vive en ellas (UNDP Population Division, 2018). El Programa de las Naciones Unidas para el Desarrollo (PNUD) estima que, hacia 2050, el 70 por ciento de la población mundial vivirá en zonas urbanas (UNDP Population Division, 2018). Esta importancia de las ciudades ha variado enormemente con el tiempo y en el espacio. Como muestra el gráfico 1, Europa, América del Norte y Oceanía ya tenían en 1950 unos niveles de urbanización superiores al 50 por ciento y han aumentado aún más desde entonces, situándose alrededor del 75-80 por ciento en la actualidad. La región de América Latina y el Caribe ha sido una de las que más se ha urbanizado en las últimas décadas. A pesar de contar solo con un 40 por ciento de su población en zonas urbanas en 1950, esta proporción alcanzó rápidamente el 80 por ciento, haciendo de todo el continente americano la región más urbanizada del mundo en la actualidad. Mientras que África y Asia presentan niveles menores de urbanización, todavía por debajo del 50 por ciento, las proyecciones disponibles indican que la mayor parte del crecimiento urbano de las próximas décadas ocurrirá en estas dos regiones (UNDP Population Division, 2018).
Vivir en las ciudades afecta a nuestra salud, tanto para bien, como para mal (Dye, 2008). En efecto, el aumento de la densidad poblacional y de las interacciones sociales y económicas tiene sus efectos positivos y negativos. Ciertos aspectos de la vida urbana son indudablemente positivos, como la mayor diversidad y el mayor acceso a trabajo y servicios. Otros aspectos son claramente negativos, incluyendo la contaminación ambiental, el hacinamiento o la exposición a anuncios de productos dañinos. Maximizar los aspectos positivos y minimizar los negativos puede contribuir a mejorar la salud de los habitantes de las ciudades.
Ahora bien, las consecuencias sobre la salud derivadas de vivir en la ciudad no afectan a todos por igual. Las clases más desfavorecidas y las minorías raciales y étnicas tienden a vivir en zonas de las ciudades con peores condiciones de vida, más contaminación, escaso acceso a recursos, etc. Esto, junto con las propias limitaciones de medios por disponer de menor renta, además de otros aspectos, como la discriminación, hacen que la prevalencia de enfermedades, tanto crónicas como agudas, sea mayor en estos grupos.
Estos efectos de las ciudades en la salud no provienen únicamente de las personas que viven en las ciudades, es decir, de sus acciones como individuos, sino también de las redes sociales que se forman en los barrios, las políticas sociales municipales, los patrones de transporte dentro de las áreas metropolitanas, las regulaciones y prácticas de los gobiernos regionales, todo ello situado en el contexto nacional y dentro de un ecosistema global. El conjunto de estos actores interviene sobre las ciudades afectando a la salud de sus residentes. Las regulaciones europeas sobre seguridad alimentaria, la reforma laboral a nivel nacional, las decisiones sobre impuestos de sucesiones, la organización local de Cáritas, y la música hasta altas horas de la madrugada del vecino del quinto: todos estos factores afectan a nuestra salud como habitantes de las ciudades. Sin embargo, no es habitual que exista una evaluación de los potenciales impactos en salud de muchas de estas políticas. La Ley General de Salud Pública 33/2011 se refería en su artículo 35 a la necesidad de realizar estas evaluaciones (Hernández-Aguado, Benavides y Porta, 2012), pero estas evaluaciones siguen sin realizarse.
3. Estudios clásicos de salud en ciudades
Gran parte de las investigaciones en salud urbana previas al siglo XX se empezaron a realizar en el siglo XVIII, en respuesta a los nuevos sistemas de producción industrial capitalista en los Países Bajos e Inglaterra para cuyo funcionamiento se requería de una masa trabajadora, lo que conllevó una migración masiva a las ciudades (Szreter, 2003). Así, el papel del agua, de la nutrición adecuada, del saneamiento y de la vivienda pasaron a tener una importancia fundamental. La necesidad de mantener una población productiva, y por ende sana, genera la necesidad por parte de las autoridades de mejorar la salud en las ciudades a través de reformas colectivas.
Estas reformas colectivas, que trajeron consigo una enorme mejora de la salud de las clases populares, es lo que denomina Bernabeu Mestre (2009) el “movimiento sanitarista urbano”. Muchos de los primeros ejemplos de este salubrismo del siglo XIX incluyen a John Snow (descubridor de la transmisión del cólera por el agua, con el consiguiente cierre de fuentes contaminadas), Edwin Chadwick (autor del informe sobre las condiciones sanitarias de la clase obrera de Gran Bretaña) y Rudolf Virchow (autor del informe sobre la epidemia de tifus en Silesia del Norte, donde afirmó que la única cura para la enfermedad consistía en una “completa democracia”). El mismo Virchow (1849) afirmó, en lo que es un texto fundacional de la salud pública moderna, que “(s)i la enfermedad es la expresión de la vida individual que transcurre bajo condiciones desfavorables, las epidemias son el síntoma de mayores perturbaciones de la vida de la masa. Siempre que muchos se encuentren en similares situaciones desfavorables, la enfermedad aparecerá también en muchos, será en[démica]– o epidémica”. En resumen, según Virchow las epidemias se generan en un contexto específico y son causadas por unas condiciones sociales determinadas.
Otros estudios clásicos de esta época incluyen el análisis de la mortalidad en barrios de París. Louis René Villermé encontró una mayor mortalidad en los barrios con una mayor proporción de hogares exentos de impuestos, es decir, que eran más pobres (Krieger, 2001). Friedrich Engels halló en Manchester un patrón similar: mayor mortalidad en zonas más desfavorecidas, con un gradiente social dentro de cada zona, de manera que las familias más pobres, independientemente de donde vivan, sufren una mayor mortalidad (Krieger, 2001). En los Estados Unidos, W.E.B. Du Bois realizó algunos de los primeros estudios en ciudades, encontrando una relación entre condiciones de vida y mortalidad en la población negra de Filadelfia (Jones-Eversley y Dean, 2018). En España, Concepción Arenal produjo numerosos textos sobre el pauperismo y las condiciones de vida de gran parte de la población española, recalcando la importancia de la enfermería de salud pública como activo en salud (Bernabeu-Mestre y Gascón Pérez, 1999). Por su parte, Salvador Allende, en su magistral resumen de la realidad médico-social chilena, dio cuenta de las diferencias en estatura, peso e indicadores de crecimiento sano, según el nivel socioeconómico de barrios y familias en 1934 (Allende, 2005; Waitzkin, 2005).
Esta atención al contexto de la salud se fue diluyendo durante el siglo XX. A medida que avanzaba el giro individualista en nuestra vida social y económica, se transitaba del paradigma ambientalista, en virtud del cual las condiciones contextuales determinan la salud, a un paradigma individualista de decisiones individuales sobre estilos de vida que confieren una mejor o peor salud (Tesh, 1988). Así pues, pasamos de investigar cómo se condicionan socialmente los hábitos, a tomar estos hábitos como determinantes de la salud en sí mismos (Armstrong, 2009).
Esta tendencia se ha revertido en las ultimas décadas, con un resurgimiento de la importancia del contexto en salud pública y en epidemiologia. Por ejemplo, en 1985 el cardiólogo británico Geoffrey Rose publicó uno de los textos más influyentes en este ámbito, titulado Individuos enfermos y poblaciones enfermas (Rose, 1985). En este texto, Rose analiza, por ejemplo, las causas que subyacen a que dos individuos en Londres tengan o no hipertensión, y a la alta prevalencia de la hipertensión en Londres y su práctica inexistencia entre los nómadas de Kenia. Según explica Rose, los determinantes de estas diferencias se deben a las características de las poblaciones, no de los individuos. En términos más actuales, que la epidemia por COVID-19 afectara inicialmente a España o Italia tiene menos que ver con decisiones individuales que tomaron españoles o italianos, y más con aspectos contextuales (Padilla y Gullón, 2020). Rose (1985) llamó a estos determinantes de las epidemias “influencias masivas”, que “actúan en la población como un todo”. Una de estas influencias masivas la constituyen los entornos urbanos, las características de las ciudades que nos confieren un mayor o menor riesgo de enfermedad, de manera diferencial a unos y otras (López y Padilla, 2017).
4. Las dinámicas de contagio en las ciudades
Las ciudades atraen gente, generan densidad e interacciones sociales. De hecho, cuanto más grande es una ciudad, más gente atrae, más densidad genera, y más interacciones sociales favorece (Sarkar y Webster, 2017). Esto tiene sus ventajas: hay más empleo, más diversidad, se genera más riqueza, más producción cultural, etc. (Sarkar y Webster, 2017). También tiene sus desventajas, incluyendo el hacinamiento, la polución, y el crimen (López y Padilla, 2017). Idealmente podríamos planear ciudades para maximizar esas ventajas y minimizar esas desventajas, haciendo que las ciudades tengan el tamaño y la densidad ideal, como se muestra en el gráfico 2, basado en un artículo de Sarkar y Webster (2017).
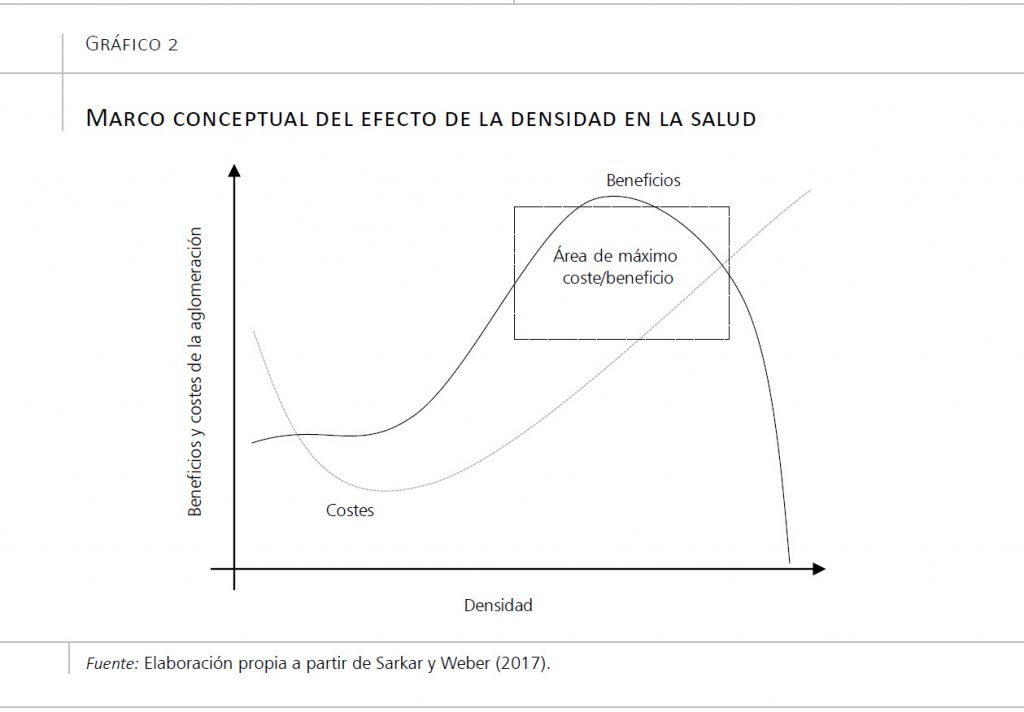
Alternativamente, podemos intentar minimizar los aspectos negativos, por ejemplo, con políticas públicas que reduzcan la contaminación, como pueden ser las restricciones al uso del coche en los centros de las ciudades o las políticas de incentivo de uso de la bicicleta mediante la creación de carriles bici.
Uno de los aspectos más atractivos de las ciudades son el mayor número de interacciones sociales que ocurren en ellas. Se da además allí un efecto de red, consistente en que el incremento de las interacciones sociales es multiplicativo, crece exponencialmente (Bettencourt, 2013; Bettencourt et al., 2007; Bettencourt y West, 2010). Este efecto, que puede parecer netamente positivo, junto con la mayor densidad de las ciudades y su mayor disponibilidad de transporte público masivo, aumenta la vulnerabilidad de las grandes urbes ante una pandemia como la provocada por el COVID-19.
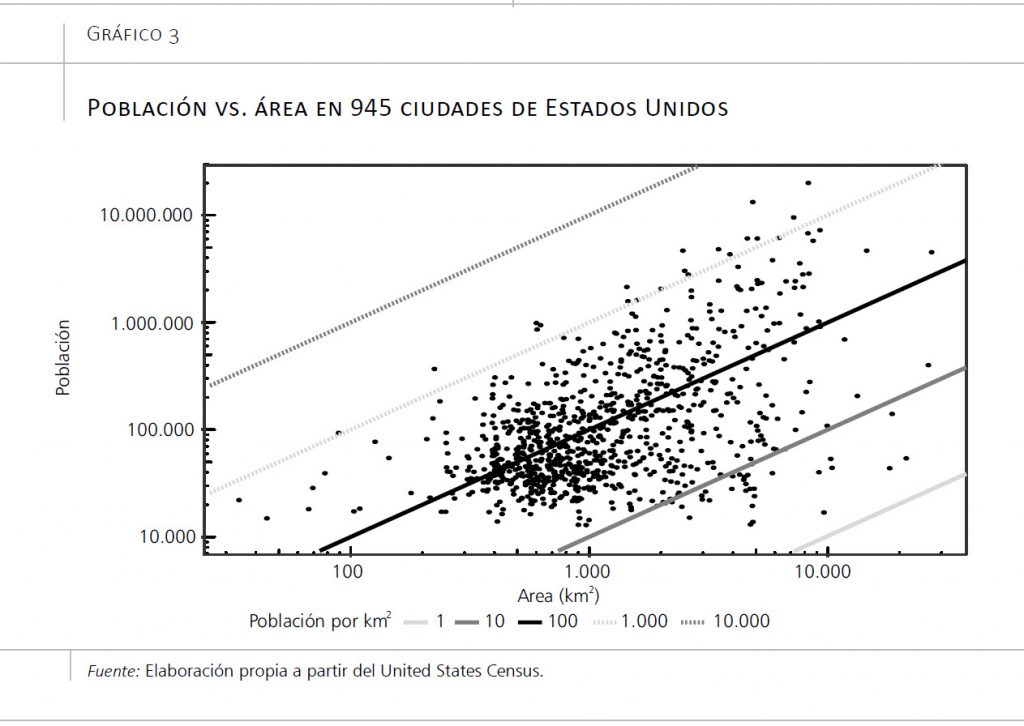
Hay varios factores importantes a la hora de considerar las ciudades como lugares donde la transmisión de enfermedades se acelera: (1) el mayor número de personas que viven y trabajan en ellas, (2) la mayor densidad de población, (3) su condición de nexos de transporte en la red internacional de viajeros, y (4) las enormes desigualdades sociales que existen en ellas. De este último factor –las desigualdades– me ocuparé en la última parte de este apartado. Respecto a los tres primeros, se trata de aspectos muy difíciles de separar entre sí. Generalmente una ciudad con una alta población tiende a presentar niveles de densidad de población más alta, pero existe muchísima variabilidad. En el gráfico 3 se muestra el área de 900 ciudades de Estados Unidos, definidas por la Oficina del Censo, junto con su población. Cada recta diagonal representa unos niveles de densidad diferentes en estas ciudades. En las ciudades más pobladas, la densidad puede ser altísima (por ejemplo, en Nueva York) o relativamente baja (por ejemplo, en Dallas), y lo mismo ocurre con las ciudades menos pobladas. Asimismo, las ciudades grandes tienden a ser, con mayor frecuencia, nexos de conexión en la red internacional de viajeros. La importancia de estos tres aspectos también depende mucho de las características de cada enfermedad. Centrémonos en tres ejemplos cuyas dinámicas de contagio han sido estudiadas en ciudades: el sarampión, la gripe y el nuevo coronavirus.
4.1. El sarampión
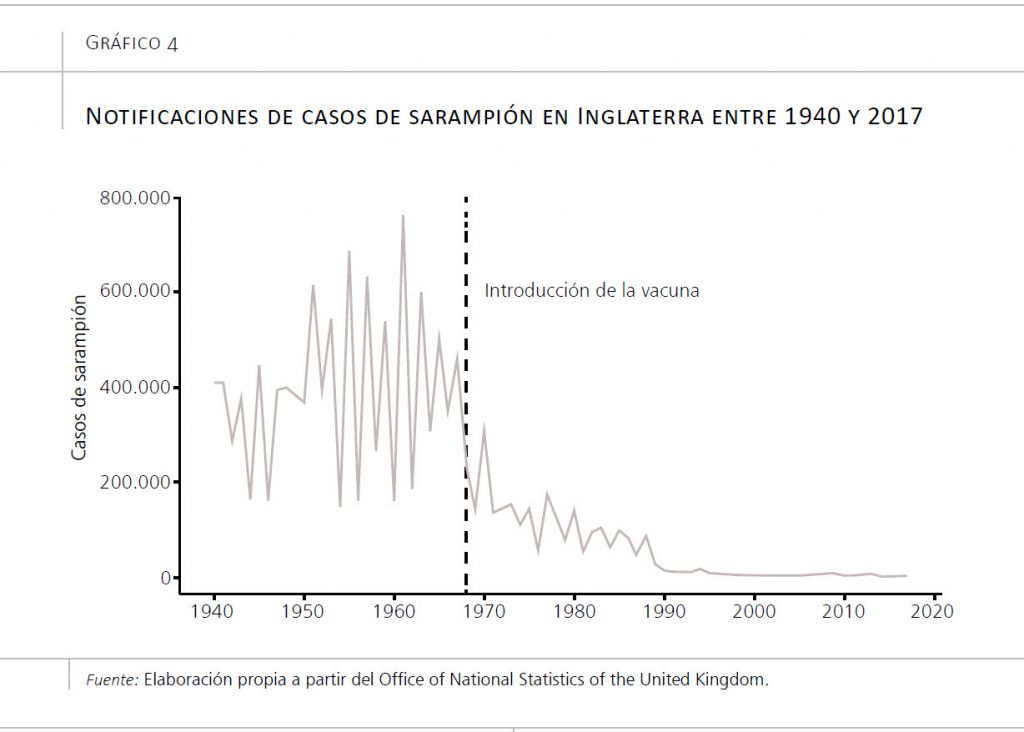
El sarampión representa uno de los mejores ejemplos de victorias inacabadas de la salud pública. En el gráfico 4 podemos ver el número de casos por sarampión en Inglaterra y Gales desde 1940 hasta 2017, con una línea vertical que indica la introducción de la vacuna, que disminuyó radicalmente el número de casos. El sarampión ha constituido un enorme problema de salud pública en los últimos dos milenios, especialmente desde el surgimiento de las grandes ciudades. Se trata de una enfermedad muy contagiosa, con un numero reproductivo básico (R0) de 12 a 18 (Guerra et al., 2017). Este valor representa el número de infecciones secundarias a un caso en una población totalmente susceptible. Es decir, si en una población sin inmunidad al sarampión se introduce a una persona infecciosa, esta contagiará a un número de personas entre 12 y 18. Estas personas, a su vez, contagiarán a otras 12-18 personas (es decir, a unas 150-300 personas), que, a su vez, contagiarán a otras 12-18 personas (es decir, a unas 2.000-5.000 personas), etc. El número de contagiados disminuirá si algunas de las personas en la población ya han pasado el sarampión, o, en tiempos modernos, han sido vacunadas contra el sarampión. Esta inmunidad individual previene que, como individuos, contraigamos la enfermedad.
Según aumentan los niveles de inmunidad individual, es decir, a medida que un mayor número de personas han superado la enfermedad o han sido vacunadas contra ella, este número de personas contagiadas irá disminuyendo. Llegará a un punto en el que sea menor que 1, lo que significa que, por cada persona contagiada, se contagiará, de media, menos de una persona. Este punto, en el que la epidemia deja de crecer exponencialmente, es lo que llamamos “inmunidad de grupo” o “inmunidad de rebaño”. En condiciones ideales, podemos calcular esta inmunidad de rebaño a partir del R0. Para el sarampión, este número rondaría el 95 por ciento: para lograr que no haya nuevas epidemias de sarampión, necesitamos que el 95 por ciento de la población sea inmune a la enfermedad, bien por infección previa o por vacunación. Es decir, la suma de inmunidades individuales no solo confiere protección a cada individuo, sino que el grupo entero (incluso el 5 por ciento no inmune, en este ejemplo) quedaría protegido contra el sarampión.
¿Qué tiene que ver esto con las ciudades? Si dejamos que una epidemia de sarampión siga su curso en una ciudad, sin ningún tipo de medida preventiva, y garantizando que la población pueda moverse con total libertad, eventualmente llegaríamos a esa inmunidad de rebaño en la que el 95 por ciento de la población ha pasado la enfermedad. Haríamos esto a un coste de vidas enorme, ya que el sarampión tiene una letalidad del 1 al 6 por ciento, pero ya no tendríamos nuevas epidemias, aunque algún viajero traiga el sarampión. Esta fue la estrategia que seguimos, inadvertidamente, durante siglos, ante la falta de otras opciones.
¿De dónde surgen las nuevas epidemias de sarampión entonces? Si una ciudad tiene a un número suficiente de personas inmunes ante la enfermedad, la única manera en la que puede haber individuos susceptibles es mediante la migración de personas o, muchísimo más importante numéricamente, mediante los nuevos nacimientos. Es decir, la tasa de natalidad de una ciudad era uno de los factores más importantes en la creación de un nuevo grupo de individuos (niños) susceptibles ante el sarampión. Y es que también es necesaria la introducción del virus, o su presencia continuada en una población (lo que llamamos endemias). Es aquí donde el tamaño de las ciudades genera dos tipos de dinámicas de contagio totalmente diferentes.
En las ciudades con un tamaño por encima de lo que se denomina el “tamaño crítico de una población” (CCS, por sus siglas en inglés: critical community size), que ronda las 300-500,000 personas (Bartlett, 1957 y 1960; Black, 1966), el sarampión es endémico; es decir, siempre está presente, aunque a niveles relativamente bajos. Existen contagios constantemente, y la presencia de un número suficiente de personas susceptibles permite que la transmisión de la enfermedad nunca se “apague”. Siempre hay “material” que quemar, utilizando la analogía del fuego en un bosque. Sin embargo, en ciudades más pequeñas, por debajo de ese límite crítico de población, el sarampión se comporta de manera epidémica (Bartlett, 1957 y 1960; Black, 1966). Es decir, tras haber contagiado a un número suficiente de personas, tras haber alcanzado el nivel de inmunidad de grupo, no aparece un número suficiente nuevo de personas para que el sarampión pueda seguir contagiando a personas, y el fuego “se apaga por falta de material que quemar”. Una vez nace un número suficiente de niños, una reintroducción del sarampión puede generar una nueva epidemia. Esta reintroducción procede generalmente de otras ciudades grandes, donde el sarampión siempre está circulando. Esta transmisión se denomina “dinámica espacial jerárquica” porque sigue una jerarquía desde ciudades grandes a pequeñas (Grenfell y Bolker, 1998; Grenfell, Bjørnstad y Kappey, 2001).
Por supuesto, con la introducción de la vacuna todas estas dinámicas cambiaron, y hoy en día, en aquellos lugares con tasas de vacunación suficientes, el sarampión solo causa pequeños brotes ocasionales, generalmente en comunidades con niveles más bajos de vacunación. Pero existen ciertos países en los que estas intervenciones de salud pública todavía no han sido lo suficientemente intensas. Por ejemplo, el fenómeno existe hoy en día en Níger (Ferrari et al., 2008), aunque con un tamaño crítico de población mucho mayor (sobre 750.000), probablemente debido a una altísima tasa de natalidad (Ferrari et al., 2008).
En resumen, el sarampión es una enfermedad muy contagiosa, que históricamente ha causado una gran mortalidad, especialmente en niños, y que presenta unas dinámicas de contagio muy diferentes según el tamaño de las ciudades. Es más, probablemente la gran mortalidad que siguió a la conquista española de América fuera causada, entre otros factores, por epidemias de sarampión en ciudades muy densamente pobladas y con una población completamente susceptible (Vågene et al., 2018).
4.2. La gripe
La gripe es una de las enfermedades infecciosas más comunes en el mundo moderno, con hasta 650.000 muertes cada año debidas a la gripe mundialmente (Iuliano et al., 2018). En España la gripe causó 1.800 muertos en 2018, y colapsa el sistema sanitario cada invierno (Padilla, 2019). La gripe está causada, de manera más frecuente, por los virus del género influenza virus A. Estos virus cuentan con dos componentes que determinan nuestra respuesta inmune al virus. Estos dos componentes, generalmente denominados H (por hemaglutinina) y N (por neuraminidasa) pueden combinarse de diferentes maneras, dando lugar a cepas diferentes. Generalmente, en un año normal, existe un número limitado de cepas circulantes que causan la mayoría de los cuadros de gripe. Las vacunas que se desarrollan cada año para la gripe contienen un número de estas cepas, que se predicen serán las más comunes en esa temporada. Además, al pasar una gripe adquirimos una cierta inmunidad a esa cepa, especialmente cuando hablamos de la primera gripe que pasamos en nuestras vidas (Henry et al., 2018). Es decir, entre esta inmunidad que tenemos y las campañas de vacunación, generalmente la gripe genera epidemias estacionales de importancia limitada, a pesar de que pueden representar una causa de muerte importante durante los inviernos. Excepcionalmente aparece una nueva cepa, generalmente mediante la combinación de otros virus existentes en animales. En 2009 se detectó en Veracruz, México, el primer caso de una nueva cepa de gripe, la H1N1 (Girard et al., 2010). Los miedos sobre su letalidad emergían principalmente de su similitud con la temida gripe de 1918, de la misma cepa (Fineberg, 2014). Por suerte, la letalidad de esta gripe fue muchísimo menor (Fineberg, 2014), y a pesar de infectar a un cuarto de la población mundial (Van Kerkhove et al., 2013), ocasionó solo la muerte a un 0,02 por ciento de los infectados (Van Kerkhove et al., 2013).
Debido a que la gripe de 2009 fue la primera pandemia en la que tenemos datos fiables de su extensión, resulta un caso de estudio muy útil para entender la transmisión de gripe en las ciudades. Durante esta pandemia, parece que el tamaño de las ciudades y su densidad no tuvo una relación con el impacto de la pandemia en ellas (Charu et al., 2017; Gog et al., 2014), pero otra variable muy relacionada tuvo una gran importancia: la conexión de las ciudades con los focos de infección, y la movilidad entre ciudades con transmisión comunitaria del virus (Charu et al., 2017; Gog et al., 2014). Es decir, no es tanto si una ciudad es grande o pequeña o si está densamente poblada o no, como su interconectividad con el mundo. Dado que las ciudades grandes tienen a ser las más conectadas, es común confundir ambos aspectos, y atribuir al gran tamaño de una ciudad la razón de que haya tenido una mayor epidemia.
4.3. El coronavirus SARS-CoV-2
¿Y, dónde queda el coronavirus en esto? Se trata de una enfermedad más contagiosa que la gripe, aunque menos que el sarampión. Parece que todos somos susceptibles, aunque nuevas investigaciones parecen hablar de cierta inmunidad cruzada con el catarro común. A diferencia del sarampión, el nuevo coronavirus aparece en un mundo conectado y globalizado. A diferencia de la gripe, la mortalidad del nuevo coronavirus parece ser de mayor magnitud.
Parece indudable, viendo los focos principales de coronavirus al inicio de la epidemia (el norte de Italia, Madrid, Londres, París, Nueva York), que las ciudades globalizadas y conectadas al mundo han sufrido esta epidemia antes que nadie. De hecho, según la Organización Mundial del Turismo, en 2018 los países más visitados por turistas fueron Francia, España, Estados Unidos, China e Italia.
Como con la gripe, parece que, entre las razones por las cuales algunas ciudades se vieron afectadas antes que otras por la pandemia de coronavirus, destaca la posición de estas ciudades en las redes internacionales de transporte de pasajeros. De hecho, a pesar de que Detroit es una ciudad relativamente pequeña, en comparación con otras de Estados Unidos, resultó ser de las más afectadas por la pandemia en marzo, incluso registrando niveles iniciales de incidencia y mortalidad superiores a los de Nueva York. ¿A qué pudo deberse? Al número de pasajeros procedentes de Asia que pasan por el aeropuerto de Detroit, nexo clave de la industria automovilística de Estados Unidos (Glass, 2020).
Esta importancia de la movilidad y el transporte también se ha observado a nivel subnacional. Por ejemplo, en un estudio recientemente publicado en Science, los autores encontraron que la movilidad entre provincias de China se hallaba altamente correlacionada con la progresión de la epidemia, de manera que las zonas más conectadas a Wuhan sufrieron un impacto más temprano (Kraemer et al., 2020). En el proyecto Factores de difusión COVID-19 en España, del Centro Nacional de Epidemiología (2020), se encontró que las provincias con una mayor conexión con Madrid sufrieron los peores impactos de la epidemia.
5. Ciudades y desigualdades
Las ciudades son lugares desiguales, donde la población queda estratificada o segregada en diferentes zonas, con unas características diferentes. En el gráfico 5 (panel de la izquierda) podemos ver un mapa de la ciudad de Madrid, con un índice de privación producido por la Sociedad Española de Epidemiología. Unos valores más altos de este índice indican una zona con peores condiciones de vida, en particular, mayor desempleo, clases ocupacionales manuales, niveles de instrucción insuficiente y escaso acceso a internet. Como se puede ver, la ciudad queda claramente dividida en una zona centro/norte/noroeste rica, y una zona sur/sureste más empobrecida.
Esta clase de desigualdades sociales conllevan también unas desigualdades en salud. En concreto, en el gráfico 5 (panel de la derecha) podemos ver un mapa de la esperanza de vida en barrios de Madrid, en el que se observa que esta puede variar hasta en 10 años. Si comparamos los dos mapas, puede verse cómo las zonas con mayor privación económica presentan, además, menor esperanza de vida.
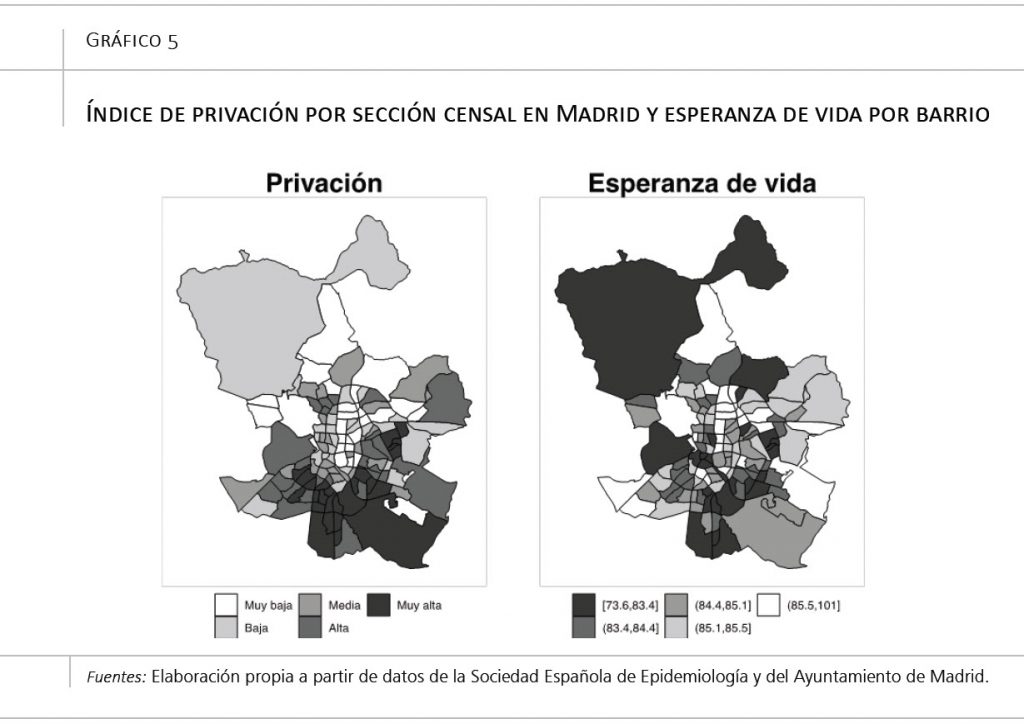
El fenómeno no es específico de Madrid. En Londres, por ejemplo, la diferencia entre la esperanza de vida de las zonas más pobres y más ricas puede llegar a los 20 años (Cheshire, 2012). Esta cifra es muy similar a la de Baltimore, donde 4 kilómetros separan dos zonas con 20 años de diferencia en esperanza de vida (Baltimore City Health Department, 2017). Esta situación se observa también en ciudades como Chicago (Hunt, Tran y Whitman, 2015), Seattle (Dwyer-Lindgren et al., 2017), o Rotterdam (Jonker et al., 2013). De hecho, semejantes diferencias no se circunscriben a Europa y Estados Unidos; también se aprecian en Latinoamérica, donde la diferencia en la esperanza de vida entre las zonas más ricas y pobres de Santiago de Chile y la Ciudad de Panamá varía entre 10 y 20 años (Bilal et al., 2019a).
Las razones subyacentes a estas desigualdades son múltiples, pero las podemos resumir en dos: diferencias en la composición y diferencias en el contexto. Las diferencias en la composición se derivan de la segregación económica que ocurre en las ciudades. Al ser la vivienda un bien de consumo, la capacidad de compra de una familia o individuo determina su capacidad de vivir en un sitio u otro. Esto acaba conduciendo a una segregación espacial, de manera que la gente con más medios vive en una zona, y la gente con menos medios, en otra zona. Dado que, como ya mencionábamos en los estudios históricos de salud urbana, la gente con más medios vive más, se muere menos y tiene mejor salud, podemos esperar que las zonas donde viva esta población tendrán también mayor longevidad y menor mortalidad. Un ejemplo de esta mayor longevidad de las personas con más medios lo encontramos en un estudio realizado con datos fiscales de Estados Unidos (Chetty et al., 2016): los autores siguieron durante 16 años a millones de personas, clasificadas según sus ingresos, y averiguaron que aquellas con mayores ingresos vivían hasta los 87/89 años (hombres/mujeres), mientras que aquellas con menos ingresos vivían hasta los 73/79 años (hombres/mujeres), de modo que la diferencia entre los hombres se situaba en 14 años, y entre las mujeres, en 10 años (gráfico 6). En un caso más cercano, utilizando datos del Servicio Catalán de Salud (CatSalut), hemos estimado que la esperanza de vida a los 18 años es 12/9 años (hombres/mujeres) más baja entre la población con recursos económicos escasos que entre la que cuenta con más recursos económicos (Bilal et al., 2019b).
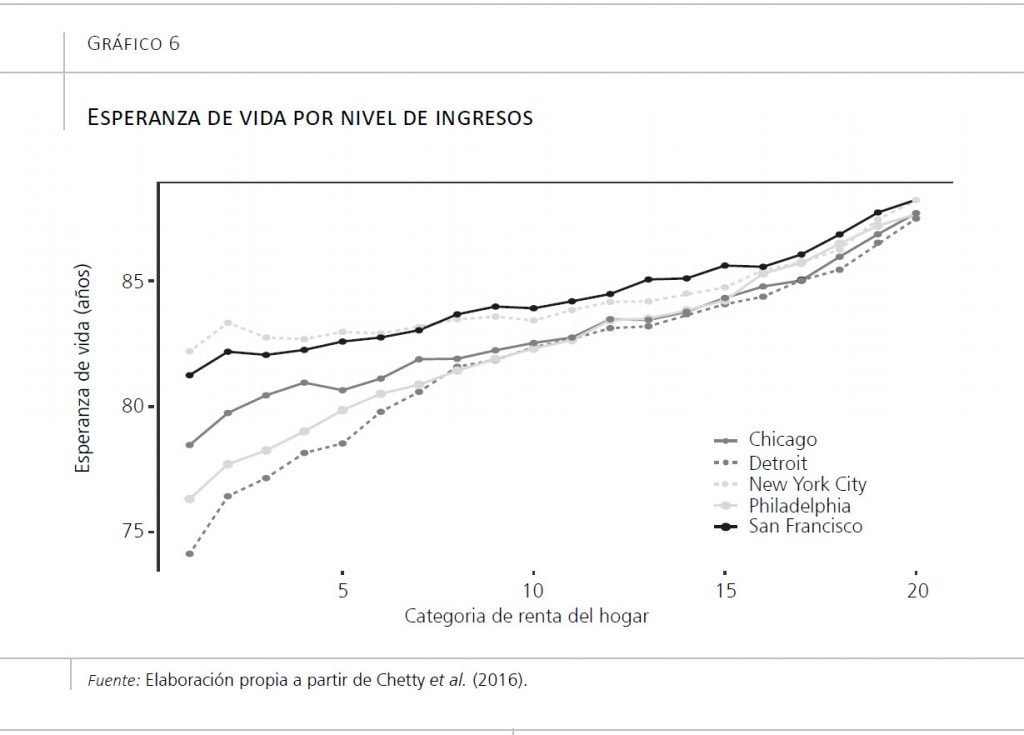
La segunda razón que puede generar desigualdades la encontramos en el contexto. Sabemos que ciertas características ambientales afectan a la salud. Vivir en zonas con mayor contaminación ambiental, cercanas a zonas con emisiones peligrosas, con mayor disponibilidad de comida basura y de puntos de venta de alcohol o tabaco, todo ello supone un riesgo para la salud. El gráfico 6, además de mostrar cómo la longevidad está fuertemente determinada por los ingresos personales, también permite distinguir diferencias, especialmente en los estratos más pobres, según dónde vivan las personas, indicando la existencia de factores contextuales de importancia.
6. Desigualdades y COVID-19
De vuelta al COVID-19, y dadas las evidencias anteriores sobre las desigualdades en salud observables en las ciudades, cabe preguntarse por la posibilidad de que esta pandemia no nos afecte a todos por igual. La narrativa recurrente al inicio de la pandemia insistía en que “el coronavirus afecta a todos por igual” y “no entiende de clases” (Padilla y Gullón, 2020). ¿Pero es cierto esto? ¿Entiende el coronavirus de clases sociales?
Para responder esta pregunta, como en toda labor científica, empezaremos trazando un marco conceptual que nos ayude a entender los posibles efectos de la desigualdad en la incidencia y mortalidad por COVID-19, y cómo esto se relaciona con los entornos en los que vivimos. El gráfico 7 muestra un resumen de este marco conceptual, basado en estudios anteriores realizados sobre la gripe (Blumenshine et al., 2008). Existen tres puntos básicos de generación de desigualdades: exposición diferencial al virus, vulnerabilidad diferencial a los efectos de la enfermedad, y diferencias en el tratamiento. Estas tres diferencias generan desigualdades en la incidencia de la enfermedad, las hospitalizaciones que ocasiona y la mortalidad que causa.
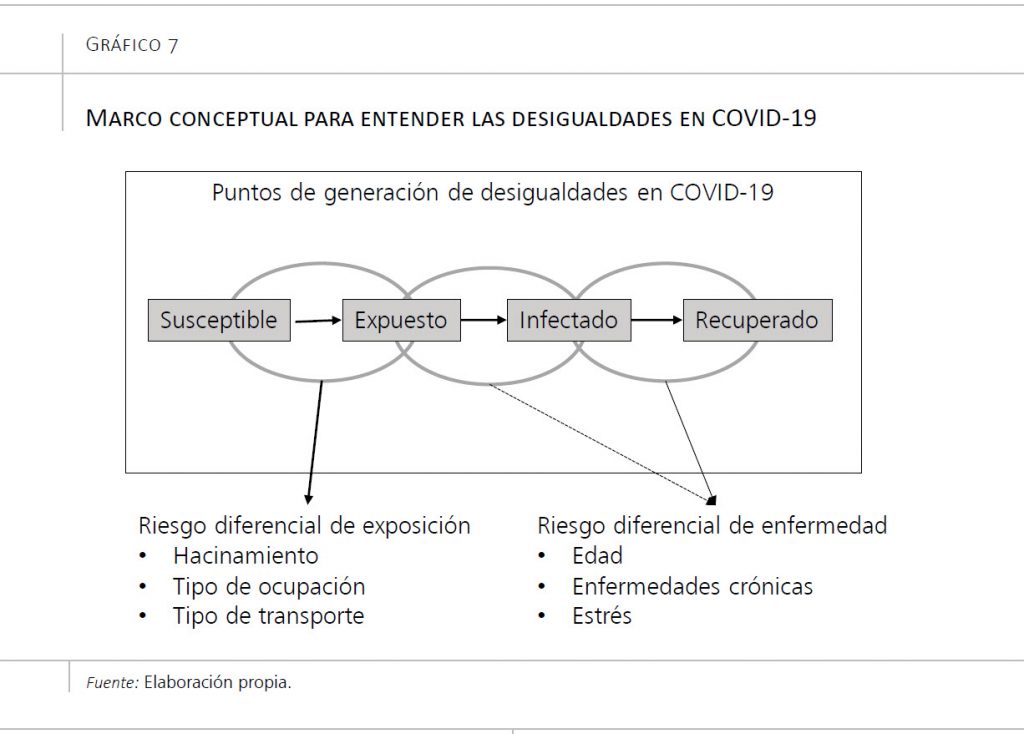
6.1. Exposición diferencial a SARS-CoV-2
La exposición diferencial al SARS-CoV-2, el virus que causa el COVID-19, emerge en los entornos laborales y domésticos. En los entornos laborales, la exposición es clara en centros sanitarios, a donde acuden personas con la enfermedad. Pero, incluso dentro de estos centros, surgen diferencias sobre quién está más o menos expuesto, o más o menos protegido. Un estudio realizado en los hospitales de Oxford cifró en un 11 por ciento la exposición al SARS-CoV-2 entre todo el personal sanitario, pero halló evidencia para señalar al personal de limpieza y apoyo (principalmente celadores) como el más expuesto a la enfermedad, muy por encima del personal médico (Eyre et al., 2020). Otros entornos laborales de riesgo incluyen todos los que reproducen las condiciones en los que mejor se transmite el virus: entornos cerrados y mal ventilados. Así, se han verificado brotes con alto número de afectados en mataderos (Dyal, 2020), gimnasios (Jang, Han y Rhee, 2020), bares y otros lugares de ocio (Furuse et al., 2020). Los trabajadores en estos lugares están mucho más expuestos que los clientes, debido al mayor tiempo que pasan en sus centros de trabajo.
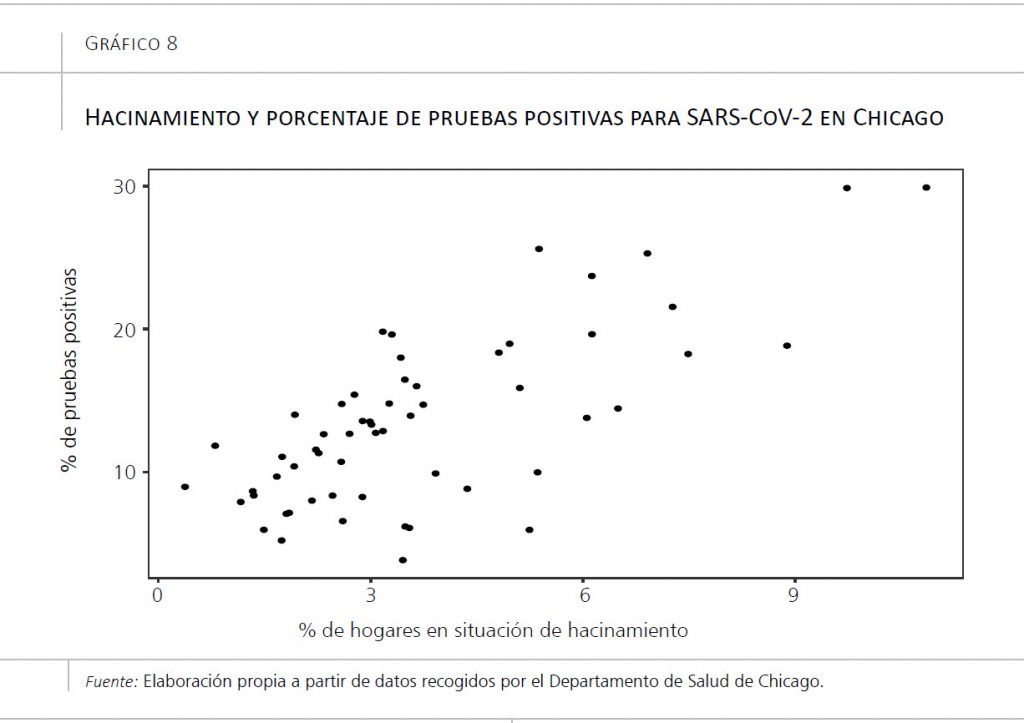
En cuanto a los entornos domésticos, el hacinamiento y las condiciones de calidad de la vivienda también suponen un factor muy importante de transmisión. De hecho, investigaciones realizadas en barrios de tres ciudades de Estados Unidos (Chicago, Nueva York y Filadelfia) han permitido concluir que los barrios con un mayor número de casas en condiciones de hacinamiento (más de una persona por cuarto) tienen una mayor incidencia de la enfermedad, como se aprecia en el gráfico 8 (Bilal, Barber y Diez-Roux, 2020).
En otros entornos, especialmente en ciudades con una alta prevalencia de asentamientos informales, la carencia de agua corriente representa una enorme barrera para una correcta higiene de manos, otro factor fundamental para prevenir la extensión del virus. Por ejemplo, en la delegación de Iztapalapa en la Ciudad de México, la incidencia de la enfermedad es muchísimo más alta que en otras delegaciones más acomodadas de la ciudad, que cuentan con unos niveles de conexión a la red municipal de aguas muy superiores (Franco, Bilal y Lazo, 2020).
6.2. Mayor vulnerabilidad a los efectos severos del COVID-19
El siguiente aspecto que puede generar desigualdades es la mayor prevalencia de enfermedades crónicas en la población con menos recursos o que vive en zonas mas desfavorecidas. Sabemos que las personas con obesidad, diabetes, hipertensión, tabaquismo, enfermedades cardiovasculares, respiratorias, hepáticas, etc., presentan una mayor probabilidad de contraer enfermedad severa por COVID-19 si se infectan. La distribución de todos estos factores no es aleatoria entre la población; antes bien, se ajusta a unos patrones sociales muy importantes en las ciudades. De hecho, como estas enfermedades son las que más frecuentemente causan mortalidad, su distribución sigue la distribución de la esperanza de vida antes mencionada.
Por ejemplo, en un estudio recientemente publicado, estudiamos la diferencia en la prevalencia de cinco factores de riesgo de enfermedad cardiovascular, por clase social, en España (Gullón et al., 2020). Estos factores en sí mismos también confieren riesgo a los efectos severos de la COVID-19: obesidad, diabetes, hipertensión, hipercolesterolemia y tabaquismo. Encontramos que entre las personas de clases sociales más aventajadas (directivos y profesionales) la prevalencia de estos factores es mucho más baja que entre las personas de clases sociales menos aventajadas (trabajadores manuales no cualificados o semicualificados). Como estas clases sociales también se segregan en las ciudades, observamos asimismo las diferencias en la prevalencia de factores de riesgo dentro de las ciudades. Por ejemplo, en un estudio de 2018 mostramos que los barrios más pobres del área noroeste de la ciudad de Madrid (distritos de San Blas-Canillejas, Barajas, Hortaleza y Ciudad Lineal) presentaban una prevalencia de diabetes mucho más alta que los barrios más adinerados (Bilal et al., 2018). Si la diabetes es un factor de riesgo para acabar hospitalizado por COVID-19, el número de personas hospitalizadas con diabetes será en estas zonas previsiblemente mayor.
¿Cuáles son las razones por las que la prevalencia de diabetes y otros factores de riesgo es mayor en estas zonas? En investigaciones previas hemos hallado que, por ejemplo, los colegios de las zonas más desfavorecidas de Madrid cuentan en sus alrededores con un mayor número de tiendas que venden productos ultraprocesados (Díez et al., 2019). En concreto, si comparamos los colegios en el tercil más pobre con los del tercil más rico, la diferencia es del 62 por ciento. También hemos comprobado que los barrios más pobres de Madrid tienen menos acceso a instalaciones deportivas (Cereijo et al., 2019), mientras que las zonas más adineradas cuentan con hasta el doble de instalaciones deportivas que las zonas más pobres. Si una alimentación adecuada y la actividad física son factores fundamentales en la prevención de diabetes, obesidad, hipertensión y enfermedad cardiovascular, en general, disponer de un entorno alimentario y de actividad física más favorable aumentará las probabilidades de poder seguir el régimen de dieta y actividad física recomendado para la prevención del riesgo cardiovascular.
6.3. Diferencias en incidencia, hospitalizaciones y mortalidad por COVID-19
La mayor exposición al virus y una mayor vulnerabilidad a sus consecuencias por parte de la población con menos recursos o que vive en zonas más desfavorecidas debería conducir a una mayor incidencia de la enfermedad y a un mayor número de hospitalizaciones y mortalidad en estas poblaciones. ¿Es este el caso?
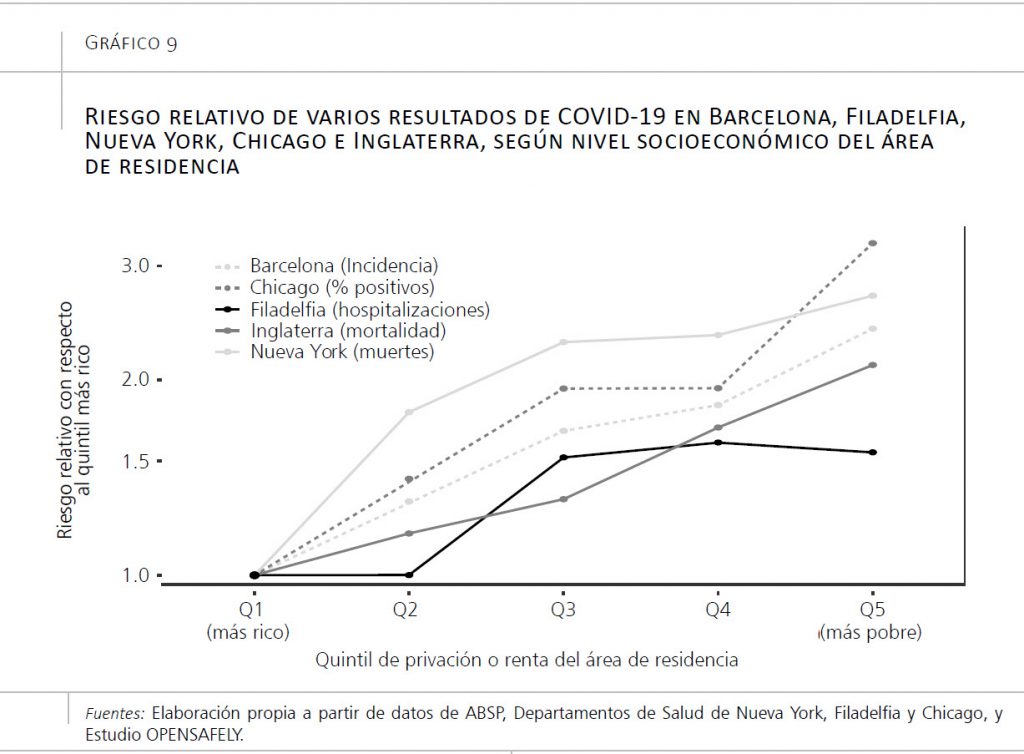
Localmente carecemos de suficientes datos al respecto todavía, pero la poca evidencia disponible ya apunta hacia este fenómeno. Así, según datos de la Agència de Salut Publica de Barcelona (2020), la incidencia en la capital catalana ha sido mucho mayor en personas que viven en zonas de renta más baja. En concreto, aquellos que viven en zonas correspondientes al quintil inferior de renta han tenido 2,4 veces más incidencia de COVID-19 que los que viven en zonas de renta más alta. En el Reino Unido, según datos del estudio OpenSAFELY basado en historias clínicas electrónicas de 17 millones de pacientes, las personas residentes en zonas con mayor privación económica tuvieron 2,1 veces mayor mortalidad por COVID-19 que las que vivían en zonas con más recursos (Williamson et al., 2020).
En un estudio sobre tres ciudades de Estados Unidos (Nueva York, Chicago y Filadelfia) también hemos encontrado enormes desigualdades en incidencia y mortalidad por COVID-19. En las tres ciudades, las personas que viven en barrios cuyos códigos postales denotan mayor nivel económico sufrieron menor incidencia y menor mortalidad (Bilal, Barber y Diez-Roux, 2020). Además, al inicio de la epidemia, los residentes en zonas más desfavorecidas tuvieron menos acceso a pruebas diagnósticas (Bilal, Barber y Diez-Roux, 2020), probablemente debido a que, en sus zonas de residencia, había menor disponibilidad de centros en los que se realizan estas pruebas (Rader et al., 2020). Según avanzó la epidemia, estas desigualdades en el acceso a pruebas se redujeron, pero persistieron desigualdades muy fuertes en incidencia y mortalidad por la enfermedad (Bilal, Barber y Diez-Roux, 2020).
El gráfico 9 resume estos resultados, mostrando diferentes indicadores (incidencia, porcentaje de pruebas positivas, mortalidad y hospitalizaciones), según el nivel socioeconómico del área de residencia, en varios contextos: Barcelona, Filadelfia, Chicago, Nueva York y toda Inglaterra. Como puede comprobarse, a pesar de ser contextos muy diferentes, con sistemas de salud muy distintos y realidades sociales muy diversas, un patrón impera de manera universal: el COVID-19 sí entiende de clases.
7. Conclusión
Las ciudades son el presente y el futuro de la humanidad; en ellas vive la mayoría de nuestra población y se genera una abrumadora mayoría de actividades. Este proceso de urbanización tiene sus ventajas y desventajas, sus aspectos positivos y negativos y, sobre todo, marca diferencias significativas en cuestiones fundamentales, como las dinámicas de contagio de enfermedades. Estas dinámicas no pueden reducirse a un simple “las ciudades son buenas” o “las ciudades son malas”, sino que dependen de cada enfermedad y de cada contexto. Con la pandemia por el nuevo coronavirus, una de las características más reseñables de las ciudades ha quedado muy en evidencia: son lugares muy desiguales. Estas desigualdades quedan reflejadas, particularmente, en la salud, y deberían atenderse prioritariamente por las políticas públicas que se diseñen e implementen en esta fase de salida de la pandemia.
BIBLIOGRAFÍA
Agència de Salut Publica de Barcelona (2020). #COVID19aldiaBCN. Recuperado de: https://aspb.shinyapps.io/COVID19_BCN/
Allende, S. (2005). Medical and social reality in Chile. International Journal of Epidemiology, 34, pp. 732-736.
Armstrong, D. (2009). Origins of the problem of health-related behaviours: A genealogical study. Social Studies of Science, 39, pp. 909-926.
Baltimore City Health Department (2017). Neighborhood Health Profile Reports. Recuperado de: https://health.baltimorecity.gov/neighborhood-health-profile-reports
Bartlett, M. S. (1957). Measles periodicity and community size. Journal of the Royal Statistical Society (Series A, General), 120, pp. 48-70.
— (1960). The critical community size for measles in the United States. Journal of the Royal Statistical Society (Series A, General), 123, pp. 37-44.
Bernabeu Mestre, J. (2009). La higiene de la habitación. Arquitectura y salud pública en la España de la Restauración. Lars: Cultura y Ciudad, 15, 15-18.
Bernabeu-Mestre, J. y Gascón Pérez, M. E. (1999). Historia de la enfermería de salud pública en España (1860-1977). Alicante: Universidad de Alicante.
Bettencourt, L. M. A. (2013). The origins of scaling in cities. Science, 340, pp. 1438-1441.
Bettencourt, L. M. A., Lobo, J., Helbing, D., Kühnert, C. y West, G. B. (2007). Growth, innovation, scaling, and the pace of life in cities. Proceedings of the National Academy of Sciences, 104, pp. 7301-7306.
Bettencourt, L. M. A. y West, G. (2010). A unified theory of urban living. Nature, 467, pp. 912-913.
Bilal, U. et al. (2019a). Inequalities in life expectancy in six large Latin American cities from the SALURBAL study: an ecological analysis. The Lancet Planetary Health, 3, pp. e503-e510.
— (2019b). Socioeconomic status, life expectancy and mortality in a universal healthcare setting: an individual-level analysis of 6 million Catalan residents. Prev Med, 123, pp. 91-94.
Bilal, U., Barber, S. y Diez-Roux, A. V. (2020). Spatial inequities in COVID-19 testing, positivity, incidence and mortality in 3 US Cities: a longitudinal ecological Study. medRxiv, 2020.2005.2001.20087833.
Bilal, U., Hill-Briggs, F., Sanchez-Perruca, L., Del Cura-González, I. y Franco, M. (2018). Association of neighbourhood socioeconomic status and diabetes burden using electronic health records in Madrid (Spain): the HeartHealthyHoods study. BMJ Open 8, e021143.
Black, F.L. (1966). Measles endemicity in insular populations: critical community size and its evolutionary implication. Journal of Theoretical Biology, 11, pp. 207-211.
Blumenshine, P. et al. (2008). Pandemic influenza planning in the United States from a health disparities perspective. Emerg Infect Dis, 14, pp. 709-715.
Centro Nacional de Epidemiología (2020). Factores de Difusion COVID-19 España. Recuperado de: https://portalcne.isciii.es/fdd/
Cereijo, L. et al. (2019). Access to and availability of exercise facilities in Madrid: an equity perspective. International Journal of Health Geographics, 18, p. 15.
Charu, V. et al. (2017). Human mobility and the spatial transmission of influenza in the United States. PLoS computational biology, 13, e1005382.
Cheshire, J. (2012). Featured graphic. Lives on the line: mapping life expectancy along the London Tube network. Environment and Planning A, 44, pp. 1525-1528.
Chetty, R., Stepner, M., Abraham, S. et al. (2016). The association between income and life expectancy in the United States, 2001-2014. JAMA, 315, pp. 1750-1766.
Díez, J. et al. (2019). Socioeconomic inequalities in the retail food environment around schools in a southern European context. Nutrients 11, p. 1511.
Dong, E., Du, H. y Gardner, L. (2020). An interactive web-based dashboard to track COVID-19 in real time. The Lancet Infectious Diseases, 20(5), pp. 533-534.
Dwyer-Lindgren, L. et al. (2017). Variation in life expectancy and mortality by cause among neighbourhoods in King County, WA, USA, 1990–2014: a census tract-level analysis for the Global Burden of Disease Study 2015. The Lancet Public Health 2, pp. e400-e410.
Dyal, J. W. (2020). COVID-19 among workers in meat and poultry processing facilities–19 States, April 2020. MMWR. Morbidity and Mortality Weekly Report, 69.
Dye, C. (2008). Health and urban living. Science, 319, pp. 766-769.
Eyre, D. W. et al. (2020). Differential occupational risks to healthcare workers from SARS-CoV-2: A prospective observational study. medRxiv, 2020.2006.2024.20135038.
Ferrari, M. J. et al. (2008). The dynamics of measles in sub-Saharan Africa. Nature, 451, pp. 679-684.
Fineberg, H. V. (2014). Pandemic preparedness and response — Lessons from the H1N1 influenza of 2009. New England Journal of Medicine, 370, pp. 1335-1342.
Franco, M., Bilal, U. y Lazo, M. (2020). Leganés, Iztapalapa y el Bronx: coronavirus y desigualdad en la ciudad global, El País, 17 de mayo.
Furuse, Y. et al. (2020). Clusters of coronavirus disease in communities, Japan, January–April 2020. Emerging Infectious Disease Journal, 26(9), pp. 2176-2179.
Girard, M. P., Tam, J. S., Assossou, O. M. y Kieny, M. P. (2010). The 2009 A (H1N1) influenza virus pandemic: a review. Vaccine, 28, pp. 4895-4902.
Glass, T. (2020). Daily COVID-19 briefing: 4/13/20. Recuperado de: https://thomasglassphd.com/2020/04/13/daily-covid-19-briefing-4-13-20/
Gog, J. R. et al. (2014). Spatial transmission of 2009 pandemic influenza in the US. PLoS Computational Biology, 10, pp. e1003635-e1003635.
Grenfell, B. T., Bjørnstad, O. N. y Kappey, J. (2001). Travelling waves and spatial hierarchies in measles epidemics. Nature, 414, pp. 716-723.
Grenfell, B. y Bolker, B. (1998). Cities and villages: infection hierarchies in a measles metapopulation. Ecology Letters, 1, pp. 63-70.
Guerra, F. M. et al. (2017). The basic reproduction number (R<sub>0</sub>) of measles: a systematic review. The Lancet Infectious Diseases, 17, pp. e420-e428.
Gullón, P., Díez, J., Cainzos-Achirica, M., Franco, M. y Bilal, U. (2020). Social inequities in cardiovascular risk factors in women and men by autonomous regions in Spain. Gaceta Sanitaria. Recuperado de: https://doi.org/10.1016/j.gaceta.2020.04.014
Henry, C., Palm, A.-K. E., Krammer, F. y Wilson, P. C. (2018). From original antigenic sin to the universal influenza virus vaccine. Trends in Immunology, 39, pp. 70-79.
Hernández-Aguado, I., Benavides, F. G., Porta, M. (2012). Los profesionales españoles de la salud pública ante la Ley General de Salud Pública. Gaceta Sanitaria, 26 (4).
Hunt, B. R., Tran, G. y Whitman, S. (2015). Life expectancy varies in local communities in Chicago: racial and spatial disparities and correlates. Journal of Racial and Ethnic Health Disparities, 2, pp.425-433.
Instituto Nacional de Estadística (2020). Información estadística para el análisis del impacto de la crisis COVID-19 / Datos de salud y mortalidad. Recuperado de: https://www.ine.es/covid/covid_salud.htm
Iuliano, A. D. et al. (2018). Estimates of global seasonal influenza-associated respiratory mortality: a modelling study. The Lancet, 391, pp. 1285-1300.
Jang, S., Han, S. H. y Rhee, J.-Y. (2020). Cluster of coronavirus disease associated with fitness dance classes, South Korea. Emerging Infectious Disease Journal, 26, p. 1917.
Jonker, M.F. et al. (2013). Small-area health comparisons using health-adjusted life expectancies: A Bayesian random-effects approach. Health Place, 23, pp. 70-78.
Kraemer, M. U. G. et al. (2020). The effect of human mobility and control measures on the COVID-19 epidemic in China. Science, 368, pp. 493-497.
Krieger, N. (2001). Historical roots of social epidemiology: socioeconomic gradients in health and contextual analysis. International Journal of Epidemiology, 30, pp. 899-900.
López, V. y Padilla, J. (2017). Salubrismo o barbarie. Sevilla: Editorial Atrapasueños.
Padilla, J. (2019). ¿A quien vamos a dejar morir? Sanidad pública, crisis y la importancia de lo político. Madrid: Capitán Swing.
Padilla, J. y Gullon, P. (2020). Epidemiocracia: nadie está a salvo si no estamos todos a salvo. Madrid: Capitan Swing.
Pollán, M. et al. (2020). Prevalence of SARS-CoV-2 in Spain (ENE-COVID): a nationwide, population-based seroepidemiological study. The Lancet, 396 (10250), pp. 535-544.
Rader, B. et al. (2020). Geographic access to United States SARS-CoV-2 testing sites highlights healthcare disparities and may bias transmission estimates. Journal of Travel Medicine, 27(7).
Rose, G. (1985). Sick individuals and sick populations. International Journal of Epidemiology, 14, pp. 32-38.
Sarkar, C. y Webster, C. (2017). Healthy cities of tomorrow: the case for large scale built environment–health studies. Journal of Urban Health, 94, pp. 4-19.
Sevillano, E. (2020). Madrid, la gran ciudad europea con el mayor exceso de mortalidad por el coronavirus, El País, 31 de julio.
Sharon, D. J.-E. y Lorraine, T. D. (2018). After 121 years, it’s time to recognize W.E.B. Du Bois as a founding father of Social Epidemiology. The Journal of Negro Education, 87, pp. 230-245.
Szreter, S. (2003). The population health approach in historical perspective. Am J Public Health, 93, pp. 421-431.
Tesh, S.N. (1988). Hidden arguments: Political ideology and disease prevention policy. New Brunswick: Rutgers University Press.
Trias-Llimos, S., Riffe, T. y Bilal, U. (2020). Monitoring life expectancy levels during the COVID-19 pandemic: Example of the unequal impact of the first wave on Spanish regions. PLOS ONE,15(11): e0241952.
UNDP Population Division (2018). World urbanization prospects, The 2018 revision. Recuperado de: https://population.un.org/wup/
Vågene, Å. J. et al. (2018). Salmonella enterica genomes from victims of a major sixteenth-century epidemic in Mexico. Nature Ecology & Evolution, 2, pp. 520-528.
Van Kerkhove et al. (2013). Estimating age–specific cumulative incidence for the 2009 influenza pandemic: a meta–analysis of A (H 1 N 1) pdm09 serological studies from 19 countries. Influenza and Other Respiratory Viruses, 7, pp. 872-886.
Virchow, R. L. K. (1849). Die Einheitsbestrebungen in der wissenschaftlichen Medizin. Druck und Verlag von G. Reimer.
Waitzkin, H. (2005). Commentary: Salvador Allende and the birth of Latin American social medicine. International Journal of Epidemiology, 34, pp. 739-741.
Williamson, E. J. et al. (2020). Factors associated with COVID-19 death using OpenSAFELY. Nature, 584, pp. 430-436.
NOTAS
* Drexel University, Philadelphia, USA (ub45@drexel.edu).
